Nội dung bài viết
Lưu huỳnh (ký hiệu S) là nguyên tố hóa học được nhắc đến khá nhiều trong sách giáo khoa các cấp. Vậy S có bao nhiêu hóa trị? Lưu huỳnh ứng dụng như thế nào vào cuộc sống ngày nay? Hãy cùng Trường Chu Văn An khám phá trong bài viết dưới đây nhé.
1. Lưu huỳnh là gì?
Lưu huỳnh là nguyên tố hóa học được ký hiệu là S. Nó có nhiều tên gọi khác nhau như: Diêm sinh, lưu huỳnh, lưu huỳnh…
Trong bảng tuần hoàn các nguyên tố hóa học, lưu huỳnh có số nguyên tử là 16. Nghĩa là có 16 proton trong hạt nhân của mỗi nguyên tử. Lưu huỳnh thuộc chu kỳ 3 và nằm trong danh mục phi kim phổ biến.
Lưu huỳnh có vai trò quan trọng trong đời sống sinh vật và con người. Lưu huỳnh là một phần của quá trình tạo ra cấu trúc cho RNA, DNA và axit nucleic.

Lưu huỳnh còn có nhiều tên gọi khác như lưu huỳnh, diêm sinh
2. Hóa trị bao nhiêu?
Tính chất hóa học của lưu huỳnh khá đa dạng. Bao gồm: Hóa trị hai, hóa trị bốn và hóa trị sáu tùy theo từng trường hợp mà chất nào được liên kết với trong phân tử.
Ví dụ: Lưu huỳnh có 2 hóa trị trong hợp chất: H2S
Lưu huỳnh có hóa trị bốn trong hợp chất: SO2
Lưu huỳnh có hóa trị sáu trong hợp chất: SO3
Lưu huỳnh có hóa trị 2, 4 và 6
3. Tính chất vật lý của lưu huỳnh
Lưu huỳnh là nguyên tố hóa học có nhiều trong tự nhiên. Khi đó, chúng tồn tại ở dạng nguyên tố đơn lẻ hoặc dạng khoáng chất. Lưu huỳnh được tìm thấy trong các khoáng chất sunfat và sunfua.
Lưu huỳnh có hai dạng: lưu huỳnh đơn nghiêng và lưu huỳnh dị nghiêng. Ở những điều kiện nhiệt độ khác nhau chúng sẽ có những tính chất đặc trưng tương ứng. Cụ thể:
- Nhiệt độ dưới 1130C: Lưu huỳnh là chất rắn có màu vàng đặc trưng.
- Nhiệt độ 1190C: Lưu huỳnh nóng chảy thành chất lỏng màu vàng.
- Nhiệt độ 1870C: Lưu huỳnh chuyển thành chất lỏng màu nâu đỏ.
- Nhiệt độ 4450C: Đây là nhiệt độ sôi của lưu huỳnh, cấu trúc của S bị phá vỡ và dễ bay hơi.
- Nhiệt độ 17000C: Hơi lưu huỳnh là nguyên tử S.
Trong cơ thể con người, hóa trị của S không quan trọng vì nó là thành phần thiết yếu. S được tìm thấy trong hai axit amin góp phần duy trì sự sống.

Ở nhiệt độ dưới 113 độ C, lưu huỳnh là chất rắn màu vàng
4. Tính chất hóa học của lưu huỳnh
Lưu huỳnh có nhiều hóa trị và có khả năng hoạt động tốt nên có nhiều tính chất hóa học đặc trưng. Bao gồm:
4.1. Phản ứng với kim loại
Trong điều kiện nhiệt độ, lưu huỳnh có thể phản ứng với kim loại tạo ra sản phẩm có số oxi hóa thấp hơn kim loại. Ví dụ:
- Zn + S → ZnS
- Fe + S → FeS
Ngoài ra, phản ứng của lưu huỳnh với kim loại còn tạo ra một số muối đặc trưng. Nổi bật là các muối sunfua như: muối CdS vàng, MnS hồng, PbS đen, CuS, Ag2S….
4.2. Lưu huỳnh phản ứng với hydro
Dựa vào kiến thức về hóa trị S là gì, bạn sẽ hiểu được tính chất hóa học của lưu huỳnh. Với các hóa trị 2, 4, 6 đa dạng, lưu huỳnh có tính oxi hóa mạnh với hydro ở nhiệt độ 3500C. Phương trình phản ứng như sau: H2 + S → H2S.
Một số phương trình phản ứng khi lưu huỳnh phản ứng với các hợp chất có tính oxi hóa mạnh như sau:
- S + 4HNO3 ngưng tụ → 2H2O + 4NO2 + SO2
- S + 2H2SO4 ngưng tụ → 3SO2 + 2H2O
4.3. Lưu huỳnh phản ứng với phi kim và các hợp chất oxi hóa mạnh
Lưu huỳnh có thể phản ứng với một số hợp chất oxy hóa hoặc phi kim loại do tính khử của nó. Trong số đó, phản ứng điển hình nhất là phản ứng với oxy:
- S + O2 → SO2
Một số phương trình phản ứng khi lưu huỳnh phản ứng với các hợp chất có tính oxi hóa mạnh như sau:
- S + 4HNO3 ngưng tụ → 2H2O + 4NO2 + SO2
- S + 2H2SO4 ngưng tụ → 3SO2 + 2H2O
5. Cách sản xuất lưu huỳnh
Lưu huỳnh có thể được sản xuất theo nhiều cách công nghiệp hoặc được điều chế trong phòng thí nghiệm. Cụ thể:
5.1. Chuẩn bị lưu huỳnh trong phòng thí nghiệm
Điều chế lưu huỳnh bằng cách đun nóng H2S hoặc khử khí lưu huỳnh đioxit.
- Đốt cháy H2S (hydro sunfua) trong điều kiện không có không khí.
Phương trình phản ứng: 2H2S + O2 → 2S 2H2O
- Khử lưu huỳnh đioxit kèm theo chất xúc tác hydro sunfua.
Phương trình phản ứng: 2H2S + SO2 → 3S + 2H2O
5.2. Khai thác lưu huỳnh trong tự nhiên
Trong tự nhiên dưới lòng đất, lưu huỳnh có thể được khai thác với số lượng lớn. Dùng ống nén nước ở nhiệt độ 1700C để thu được lưu huỳnh nóng chảy. S nóng chảy sau đó sẽ chảy xuống lòng đất và được khai thác bằng hệ thống máy móc chuyên dụng.
Lưu huỳnh thu được ở dạng lỏng sau khi làm mát. Cuối cùng được chuyển thành bột để sử dụng.
6. Ứng dụng lưu huỳnh
Lưu huỳnh được sử dụng rộng rãi trong y học và công nghiệp. Cụ thể:
- Ứng dụng của lưu huỳnh trong y học: Sử dụng lưu huỳnh để bào chế một số loại thuốc như thuốc nhuận tràng, thuốc có đặc tính kháng khuẩn, chống viêm để điều trị các rối loạn về da.
- Ứng dụng của lưu huỳnh trong công nghiệp: Dùng để sản xuất thuốc súng, diêm, bột giặt, thuốc nhuộm. Lưu huỳnh còn được dùng để lưu hóa cao su và sản xuất axit sulfuric H2SO4.
- Ứng dụng lưu huỳnh trong nông nghiệp: Lưu huỳnh là nguyên liệu trong sản xuất thuốc diệt nấm, thuốc trừ sâu, phân bón…
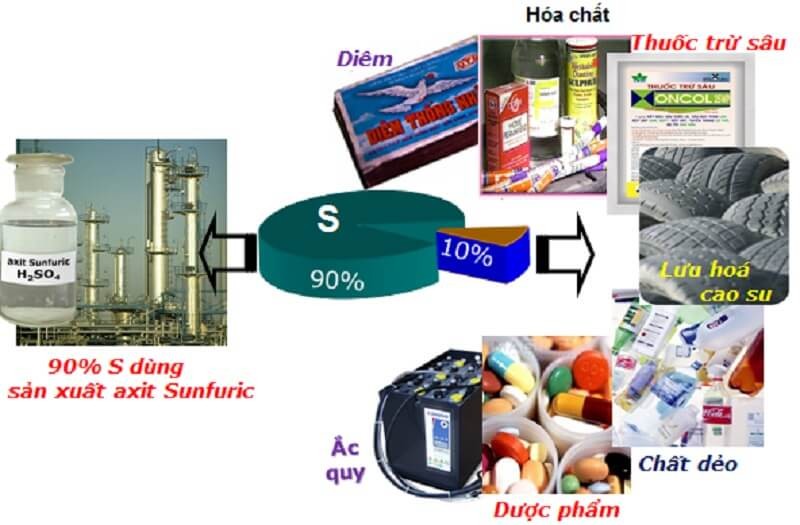
Lưu huỳnh có nhiều ứng dụng trong cuộc sống
Phương pháp hóa trị đã được chia sẻ cụ thể ở bài viết trên. Hy vọng những chia sẻ sẽ giúp các bạn hiểu rõ hơn về nguyên tố hóa học quan trọng và cần thiết này. Nếu bạn có nhu cầu tìm hiểu về S và các nguyên tố hóa học khác vui lòng liên hệ Trường Chu Văn An theo số đường dây nóng của chúng tôi để được giải đáp.


Nội dung được phát triển bởi đội ngũ truongchuvananhue.edu.vn với mục đích chia sẻ và tăng trải nghiệm khách hàng. Mọi ý kiến đóng góp xin vui lòng liên hệ tổng đài chăm sóc: 1900 0000 hoặc email: hotro@truongchuvananhue.edu.vn