Nội dung bài viết
NH4Cl – Amoni Clorua là chất vô cơ được sử dụng rộng rãi trong nhiều ngành công nghiệp từ sản xuất phân bón, luyện kim, thực phẩm đến y học. Bài viết dưới đây Trường Chu Văn An sẽ giúp các bạn tìm hiểu NH4Cl là gì, tính chất lý hóa điển hình của nó và những ứng dụng quan trọng của chúng trong thực tế. Hãy cùng theo dõi nhé!
I. NH4Cl là gì? Amoni clorua là gì?
Đây là một hợp chất vô cơ có công thức hóa học NH4Cl. Đây là loại muối kết tinh màu trắng, hòa tan cao trong nước, là sản phẩm được tạo ra từ axit clohydric và amoniac.
Sal amoniac là tên khoáng vật tự nhiên của hóa chất này và thường hình thành trên các bãi đốt than sau khi ngưng tụ khí có nguồn gốc từ than. Chúng cũng có thể được tìm thấy xung quanh một số vụ phun trào núi lửa.
Một số tên gọi khác: muối lạnh, amoni clorua, phân amoni clorua, muối amoniac, muối Nushadir, Amoni Muriate…

NH4Cl là gì?
II. Tính chất vật lý và hóa học của Amoni clorua – NH4Cl
1. Tính chất vật lý của NH4Cl
|
khối lượng cụ thể |
1,5274 g/cm3 |
|
điểm nóng chảy |
338 oC (611 K, 640 oF) |
|
điểm sôi |
520oC (793 K, 968 oF) |
|
Độ hòa tan trong nước |
– Ở -15oC: 244 g/l – 0oC: 294 g/l – 25oC: 383 g/l – 40oC: 454,4 g/l – 100oC: 740,8 g/l |
|
Các đặc điểm khác |
– Là một trong những hợp chất vô cơ – Dạng tinh thể hoặc dạng hạt màu trắng, không mùi, có vị mặn và hút ẩm. – Dung dịch này có tính axit yếu |
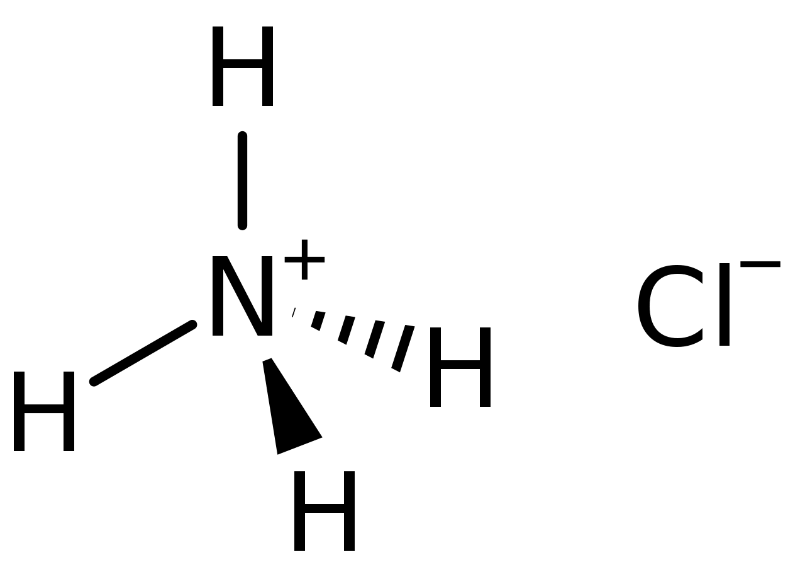
NH4Cl là gì? Công thức cấu tạo
2. Tính chất hóa học của Amoni clorua
- Sẽ thăng hoa khi đun nóng nhưng thực chất bị phân hủy thành amoniac cùng với khí hydro theo phương trình điện phân sau:
NH4Cl → NH3 + HCl
- Phản ứng với các bazơ mạnh như NaOH để giải phóng khí amoniac
NH4Cl = NaOH → NH3 + NaCl + H2O
- Phản ứng với cacbonat kim loại kiềm ở nhiệt độ cao tạo ra khí NH3 và clorua kim loại kiềm như NaNO3, AgNO3, NaNO2, KNO3, Na3PO4
NH4Cl + NaCO3 → 2NaCl + CO2 + H2O + 2NH3
- Dung dịch amoni clorua 5% trong nước có pH khoảng 4,6 – 6,0 sẽ làm quỳ tím chuyển sang màu đỏ.
III. Làm thế nào để điều chế/sản xuất amoni clorua?
- NH4Cl có sẵn trong tự nhiên, nó có thể được tìm thấy xung quanh các khu vực núi lửa, hình thành trên đá núi lửa gần các miệng thoát khí (fumarole).

NH có thể được tìm thấy4Cl ở xung quanh khu vực núi lửa
- Nó cũng có thể được điều chế từ phản ứng giữa amoniac (NH3) và hydro clorua (khí) hoặc axit clohydric (dung dịch):
NH3 + HCl → NH4Cl
- Hoặc được sưu tầm từ công nghệ Solvay
CO2 + 2NH3 + 2NaCl + H2O → 2NH4Cl + Na2CO3
IV. Ứng dụng Amoni Clorua trong đời sống và sản xuất
1. Trong sản xuất phân bón
- Một trong những ứng dụng chính của NH4Cl là làm nguyên liệu cho ngành sản xuất phân bón (90% sản lượng NH4Cl trên thế giới). Hoạt động như một nguồn nitơ trong phân bón.
- Một số loại cây trồng sử dụng nguồn nitơ trên là: lúa mì, lúa Á, rau màu,…

Amoni clorua được coi là nguồn cung cấp nitơ trong phân bón
2. Trong ngành thực phẩm
- NH4Cl được sử dụng làm phụ gia thực phẩm theo số E E510. Chúng thường được sử dụng làm chất dinh dưỡng trong men để nướng bánh mì.
- Chúng được sử dụng làm chất tạo ngọt cho cam thảo mặn và làm hương liệu trong Salmiakki Koskenkorva Vodka.
- Amoni clorua được bổ sung vào thức ăn chăn nuôi và là thành phần không thể thiếu trong môi trường dinh dưỡng cho nấm men.
3. Trong ngành luyện kim
- Hóa chất này dùng để làm sạch bề mặt phôi bằng cách phản ứng với các oxit kim loại trên bề mặt tạo ra clorua kim loại dễ bay hơi. Ngoài ra, chúng còn được dùng làm chất điện phân trong pin carbon-kẽm.
4. Ứng dụng NH4Cl trong y học
- Amoni clorua được dùng làm thuốc long đờm hiệu quả trong thuốc ho, bằng cách tác động lên niêm mạc phế quản, làm cho đờm dễ long ra hơn.
- Muối amoni tinh khiết gây kích ứng niêm mạc dạ dày và gây buồn nôn.
5. Ứng dụng khác của hóa chất NH4Cl
- NH4Cl khi sử dụng trong dung dịch nước 5% được áp dụng trên các giếng có vấn đề trương nở do đất sét.
- Chúng cũng có thể được tìm thấy trong dầu gội, keo dán ván ép hoặc chất tẩy rửa thiết bị.
- Được sử dụng trong các ngành công nghiệp in ấn, thuộc da, nhuộm và phân cụm bông
- Vào thế kỷ 18, chúng còn được sử dụng trong sản xuất pháo hoa để tăng cường màu xanh lục và xanh lam.

Vào thế kỷ 18, Amoni clorua còn được sử dụng để chế tạo pháo hoa
V. Những lưu ý cần thiết khi sử dụng và bảo quản NH4Cl
- NH4Cl còn được biết đến là một loại hóa chất khá nguy hiểm, gây ăn mòn và kích ứng mắt nghiêm trọng. Nếu nuốt phải có thể gây ngộ độc cấp tính. Vì vậy, khi tiếp xúc với chúng, bạn cần trang bị đầy đủ đồ bảo hộ: găng tay, găng tay, kính, mũ,… và tuân thủ nghiêm ngặt các quy định về an toàn hóa chất.
- Bảo quản nơi khô ráo, thoáng mát, tránh ánh nắng trực tiếp và mưa, trong thùng chứa chuyên dụng, v.v.
VI. Gợi ý nơi mua Amoni Clorua – NH4Cl chất lượng, giá tốt
Nếu bạn đang có nhu cầu mua hóa chất chất lượng, giá tốt thì không nên bỏ qua Công ty Trường Chu Văn An. Đây là một trong những địa chỉ tin cậy chuyên cung cấp các loại hóa chất công nghiệp, hóa chất phòng thí nghiệm uy tín, trong đó có hóa chất NH4Cl. Khi mua hàng tại đây bạn có thể yên tâm về chất lượng cũng như giá cả tốt trên thị trường. Bên cạnh đó, Trường Chu Văn An còn mang đến cho khách hàng dịch vụ giao hàng nhanh chóng, chuyên nghiệp cùng nhiều chính sách ưu đãi khác.
Hy vọng bài viết trên đã giúp bạn đọc hiểu rõ hơn về NH4Cl là gì, tính chất và ứng dụng của nó. Liên hệ ngay với Trường Chu Văn An qua hotline 0826 010 010 hoặc nhắn tin qua website vetchem.com.vn nếu có thắc mắc liên quan đến sản phẩm hoặc cần tư vấn, báo giá đặt mua hóa chất amoni clorua.
VII. Một số câu hỏi thường gặp về Amoni clorua
Amoni clorua có làm đổi màu quỳ tím không?
Làm quỳ tím ẩm chuyển sang màu đỏ
Amoni clorua thành Amoni nitrat?
AgNO3 + NH4Cl → AgCl + NH4NO3 là phản ứng trao đổi, AgNO3 (bạc nitrat) phản ứng với NH4Cl (amoni clorua) tạo ra AgCl (bạc clorua), NH4NO3 (amoni nitrat), không cần điều kiện phản ứng
NH4Cl là muối axit hay bazơ?
Dung dịch amoni clorua có tính axit yếu
NH4Cl có tan trong nước không?
NH4Cl là muối kết tinh màu trắng, tan nhiều trong nước




Nội dung được phát triển bởi đội ngũ truongchuvananhue.edu.vn với mục đích chia sẻ và tăng trải nghiệm khách hàng. Mọi ý kiến đóng góp xin vui lòng liên hệ tổng đài chăm sóc: 1900 0000 hoặc email: hotro@truongchuvananhue.edu.vn