Nội dung bài viết
Trong hóa học, khi tìm hiểu về tính chất vật lý, chắc chắn chúng ta thấy xuất hiện yếu tố hòa tan. Hãy cùng vietchem tìm hiểu độ hòa tan là gì, công thức tính độ hòa tan và những yếu tố nào sẽ ảnh hưởng đến độ hòa tan của một chất, qua nội dung bài viết dưới đây nhé!
I. Độ hòa tan là gì?
1. Khái niệm độ hòa tan
– Độ hòa tan hay độ hòa tan là đại lượng đặc trưng cho khả năng hòa tan của một chất (rắn, lỏng hoặc khí) trong dung môi tạo thành dung dịch đồng nhất. Hay còn hiểu là số gam chất đó hòa tan trong 100g dung môi (thường là nước) để tạo ra dung dịch bão hòa ở điều kiện nhiệt độ nhất định.

Độ hòa tan là gì?
– Người ta thường dựa vào đặc điểm này để xác định một chất là chất hòa tan hay không hòa tan:
- Nếu 100g nước có thể hòa tan được hơn 10g một chất thì đó sẽ là chất hòa tan hoặc tan được
- Nếu 100g nước có thể hòa tan ít hơn 1g chất đó thì đó là chất ít tan
- Nếu 100g nước chỉ hòa tan được ít hơn 0,01g một chất thì gọi là không tan
2. Độ hòa tan của muối, axit, bazơ trong nước
– Hầu hết các axit đều tan trong nước, trừ axit silicic (H2SiO3)
– Hầu hết bazơ đều không tan trong nước, trừ NaOH, Ba(OH)2, KOH,… và Ca(OH)2 ít tan trong nước
– Muối:
- Tất cả các muối natri, K và nitrat (-NO3) đều hòa tan trong nước.
- Hầu hết các muối clorua và sunfat đều hòa tan.
- Hầu hết các muối cacbonat sẽ không hòa tan.
II. Công thức tính độ hòa tan là gì?
– Độ hòa tan được xác định theo công thức:
S = (mct/mdm) x 100
Trong đó:
- S là ký hiệu cho độ hòa tan
- mct là khối lượng chất tan
- mdm là khối lượng dung môi
Ví dụ: Xác định độ tan trong nước của muối Na2CO3 (khi ở 18 độ C). Biết rằng, ở nhiệt độ này nếu hòa tan 53g Na2CO3 vào 250g nước sẽ thu được dung dịch bão hòa.
Độ tan của muối Na2CO3 là: SNa2CO3 = 53 x 100/ 250 = 21,2g.

Cách tính độ hòa tan của một chất
– Từ công thức trên, ta cũng có thể suy ra mối liên hệ giữa độ tan của một chất và nồng độ phần trăm của dung dịch bão hòa của nó ở một nhiệt độ nhất định:
C% = 100 x S/ (100 + S)
Độ hòa tan càng thấp thì chất đó càng ít tan và ngược lại.
III. Các yếu tố ảnh hưởng đến độ hòa tan của một chất
1. Nhiệt độ
- Đối với một chất khí, độ hòa tan của nó trong dung môi tỷ lệ nghịch với nhiệt độ. Vì vậy, chúng ta có thể loại bỏ các khí như O2, CO2 ra khỏi dung môi bằng cách đun nóng mà không làm biến đổi hay phân hủy các chất, không những vậy mà còn duy trì được tính ổn định của dược chất.
- Đối với chất rắn thu nhiệt, nhiệt độ càng cao thì độ hòa tan càng lớn. Đối với chất rắn khi hòa tan tỏa nhiệt thì nhiệt độ càng cao thì độ hòa tan càng thấp.
2. Áp suất (đối với chất khí)
Theo định luật Henry, đối với những chất khí có độ hòa tan thấp và áp suất không quá cao thì lượng khí hòa tan trong một thể tích chất lỏng xác định sẽ tỉ lệ thuận với áp suất của nó lên bề mặt chất lỏng ở nhiệt độ. không thay đổi. Do đó, nếu áp suất tăng thì độ hòa tan của khí sẽ tăng và ngược lại.
3. Độ phân cực của chất tan và dung môi
- Các chất phân cực dễ tan trong các dung môi phân cực như nước, kiềm, axit vô cơ, dung dịch muối…
- Các chất ít phân cực dễ tan trong các dung môi hữu cơ ít phân cực như cloroform, toluen, benzen, diclometan,…
4. Phân bổ
Chất rắn vô định hình sẽ có độ hòa tan lớn hơn chất rắn kết tinh. Nguyên nhân là do dạng tinh thể có cấu trúc mạng tinh thể tương đối ổn định. Do đó, cần nhiều năng lượng hơn để phá vỡ cấu trúc. Tuy nhiên, chất rắn vô định hình không bền bằng chất rắn kết tinh và thường có xu hướng biến thành tinh thể.
5. Hiện tượng hydrat hóa
Trong quá trình kết tinh, chất rắn có thể tồn tại ở dạng khan hoặc ngậm nước. So với dạng ngậm nước, chất rắn ở dạng khan có độ hòa tan cao hơn.
6. Hiện tượng đa hình
Tùy thuộc vào điều kiện kết tinh, chất rắn có thể có các dạng tinh thể khác nhau như đồng tinh thể, hydrat, v.v. với các tính chất vật lý và độ hòa tan trong dung môi khác nhau. Đối với các tinh thể kém ổn định hơn, cần ít năng lượng hơn để phá vỡ cấu trúc, do đó chúng hòa tan dễ dàng hơn.
7. pH của dung dịch
- Khi kiềm hóa dung môi, độ hòa tan của axit yếu sẽ tăng lên
- Nếu dung môi bị axit hóa, chất kiềm yếu sẽ có độ hòa tan tăng
- Đối với các chất lưỡng tính, pH càng gần điểm đẳng điện thì độ hòa tan càng thấp và ngược lại.
8. Chất điện giải
Chất điện phân trong dung dịch có khả năng làm giảm độ hòa tan của chất tan nên cần chú ý pha loãng chất điện phân trước khi trộn vào dung dịch.
9. Ion cùng tên
Khi nồng độ của các ion cùng tên tăng lên, cân bằng điện giải của chất tan sẽ dịch chuyển dần về phía phân tử ít tan hơn và làm giảm độ hòa tan của chất đó. Vì vậy, để thực hiện quá trình hòa tan, cần tiến hành xử lý chất ít tan trước, sau đó mới đến chất tan nhiều.
10. Hỗn hợp dung môi
Khi kết hợp các hỗn hợp dung môi hòa tan trong nước như glycerin-etanol-nước thì độ hòa tan của các chất không hòa tan sẽ tăng lên.
IV. Bảng độ hòa tan hóa học của một số chất
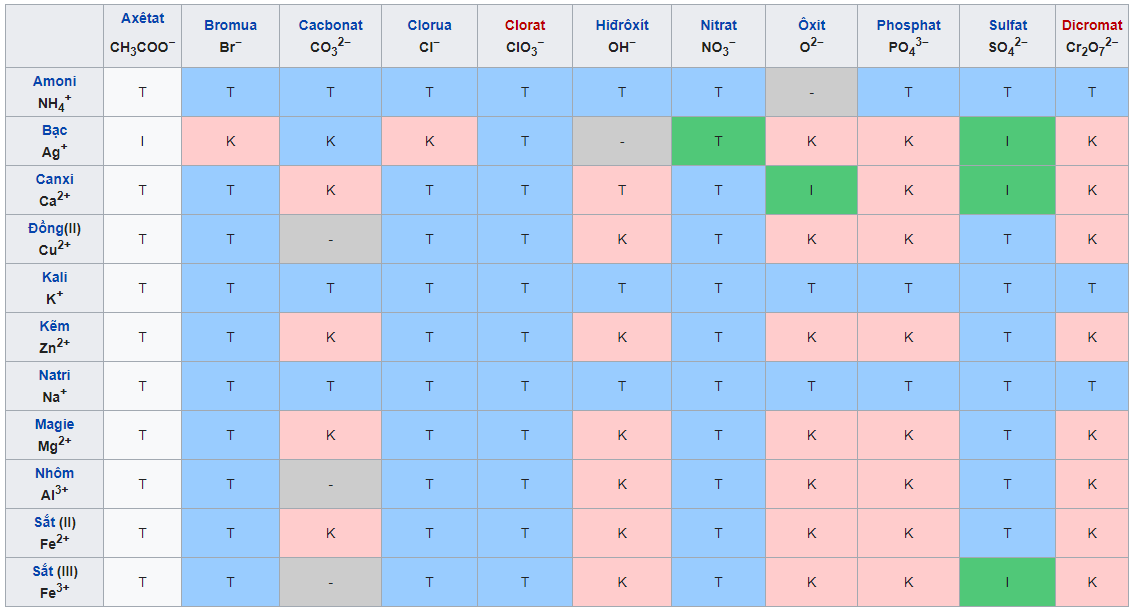
Bảng độ tan của muối, axit, bazơ
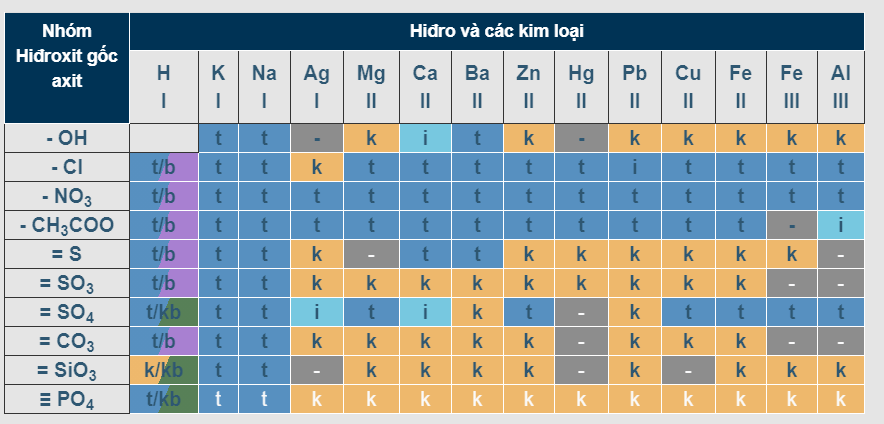
Bảng độ hòa tan của hydro và kim loại
Trong đó:
- T: chất hòa tan
- I: Chất ít tan
- K: Chất không hòa tan
- B: Chất dễ bay hơi
- (-): chất không tồn tại hoặc sẽ bị phân hủy bởi nước
V. Hướng dẫn cách đọc bảng tính độ tan đơn giản nhất
– Bảng độ hòa tan gồm các hàng cho anion axit (OH-) và cột cho cation kim loại. Tùy theo từng chất cụ thể mà chúng ta sẽ xác định được ion dương và ion âm, sau đó sắp xếp chúng theo hàng, cột tương ứng để biết trạng thái của chất đó trong một tế bào.
– Bạn có thể tham khảo cách học bảng độ tan qua các bài thơ như:

Cách ghi nhớ bài toán bằng thơ
Cách ghi nhớ bảng độ tan:
|
hợp chất |
Thiên nhiên |
Ngoài |
|
Axit (xem cột ion H+ với anion bazơ axit tương ứng) |
Tân |
H2SiO3 |
|
Base (cách xa hàng in OH- với các cation tương ứng) |
Không hòa tan |
NaOH, KOH, LiOH, Ca(OH)2, NH4OH, Ba(OH)2 |
|
– Muối liti – Muối natri – Muối kali – Muối amoni |
Tân |
|
|
– Muối bạc |
Không hòa tan (AgCl) |
AgNO3, CH3COOAg |
|
– Muối nitrat – Muối axetat |
Tân |
|
|
– Muối clorua – Muối bromua – Muối iod |
Tân |
– AgCl: kết tủa màu trắng – AgBr: kết tủa màu vàng nhạt – Agl: kết tủa màu vàng – PbCl2, PbBr2, Pbl2 |
|
– Muối sunfat |
Tân |
– BaSO4, PbSO4, CaSO4: kết tủa màu trắng – Ag2SO4: ít tan |
|
– Muối sunfit – Muối cacbonat |
Không hòa tan |
Muối của kim loại kiềm với amoni NH4+ |
|
– Muối sunfua |
Không hòa tan |
Muối của kim loại kiềm, đất kiềm và amoni NH4+ |
|
– Muối photphat |
Không hòa tan |
Muối, Na+, K+ và amoni NH4+ |
Trên đây là những thông tin cơ bản về độ hòa tan là gì, công thức tính cũng như cách ghi nhớ độ hòa tan đơn giản nhất. Hy vọng với bài viết này, bạn đọc sẽ có được những tài liệu tham khảo hữu ích cho mình. Liên hệ Trường Chu Văn An qua hotline 0826 010 010 nếu có thắc mắc liên quan.




Nội dung được phát triển bởi đội ngũ truongchuvananhue.edu.vn với mục đích chia sẻ và tăng trải nghiệm khách hàng. Mọi ý kiến đóng góp xin vui lòng liên hệ tổng đài chăm sóc: 1900 0000 hoặc email: hotro@truongchuvananhue.edu.vn