Nội dung bài viết
Xung quanh chúng ta có rất nhiều vật liệu phổ biến, trong đó có kim loại, thành phần chính của chúng là hợp kim. Kim loại là vật rắn có tính dẫn điện, dẫn nhiệt và rắn. Vậy cụ thể, tính chất hóa học điển hình của kim loại là gì? Bài viết dưới đây đã được chúng tôi tổng hợp chi tiết và mời bạn đọc tiếp ngay nhé.
1. Tính chất hóa học đặc trưng của kim loại ngày nay
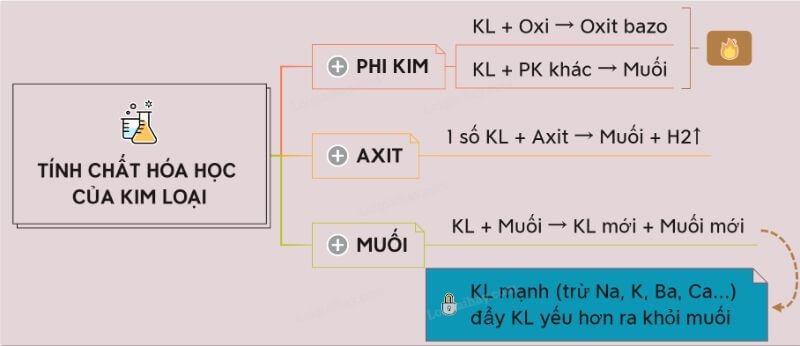
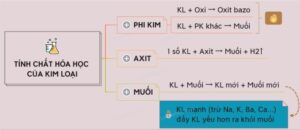
1.1. Kim loại tác dụng với oxi
Hầu hết các kim loại có thể phản ứng với oxy ở nhiệt độ bình thường hoặc cao và sẽ tạo thành các hợp chất oxit. Tuy nhiên, một số kim loại như vàng (Au), bạc (Ag) và Plat (PT) trong điều kiện bình thường sẽ không phản ứng với oxy.
Ví dụ: 2O2 + 3Fe Fe3O4
1.2. Kim loại tác dụng với axit
Để tạo ra khí hydro và muối, kim loại thường phản ứng với axit. Phản ứng này và sự giải phóng khí hydro thường đi đôi với nhau.
Ví dụ: Fe + 2HCl → FeCl2 + H2
Hình 1: Tính chất hóa học điển hình của kim loại
1.3. Kim loại tác dụng với phi kim
Ở phía bên phải của bảng tuần hoàn là các nguyên tố phi kim. Chúng không dẫn điện, trừ trường hợp đặc biệt như carbon (C) ở dạng than chì.
Kim loại có khả năng oxi hóa khi phản ứng với oxi và nhường electron cho phi kim. Hoặc khi tương tác với các phi kim khác sẽ tạo ra các muối như lưu huỳnh (S) hoặc clo (Cl).
Ví dụ: Cu + S → CuS
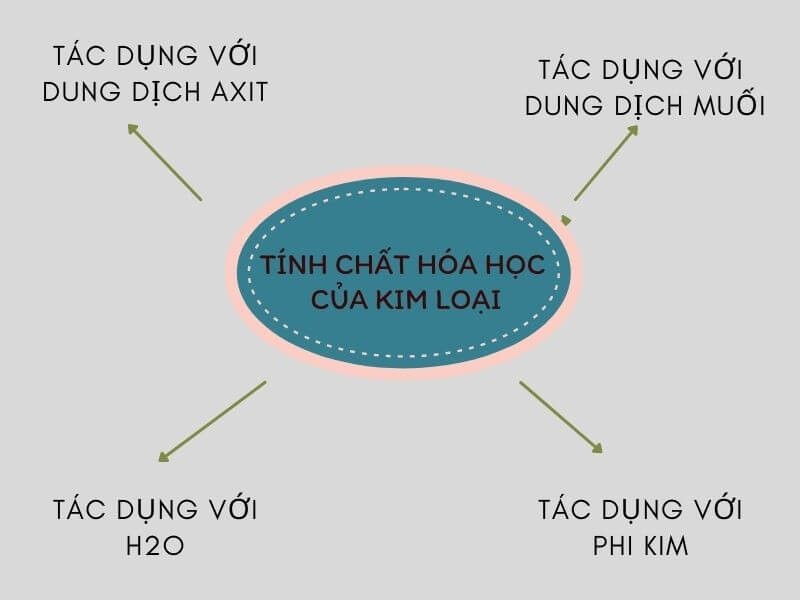
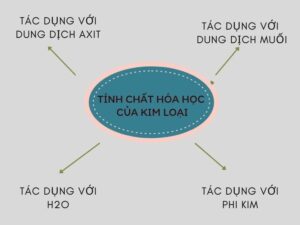
1.4. Kim loại tác dụng với nước
Kim loại có thể phản ứng với nước ở nhiệt độ cao hoặc bình thường tạo thành bazơ, khí hydro và oxit hoặc kim loại kiềm. Phản ứng này còn giúp kim loại tăng khả năng tương tác với nước.
Ví dụ: 2Na + 2H2O → 2NaOH + H2
Hình 2: Kim loại phản ứng với nước
1.5. Kim loại tác dụng với muối
Kết hợp một kim loại với muối của kim loại khác có thể tạo ra muối mới và kim loại khác. Điều này thường xảy ra và là một phần quan trọng trong việc tạo ra hợp kim và hợp chất kim loại trong các quá trình hóa học.
Ví dụ: Fe + CuSO4 → Cu + FeSO4
2. Cấu tạo và phân nhóm kim loại
2.1. Kết cấu
Cấu trúc nguyên tử
Nguyên tử của hầu hết các nguyên tố kim loại có ít electron ở lớp vỏ ngoài cùng (1e, 2e hoặc 3e).
Ví dụ: Na: [Ne] 3s1 ; Magiê : [Ne] 3s2 ; Al: [Ne] 3s23p1
Trong cùng thời kỳ, nguyên tử của các nguyên tố kim loại có bán kính nguyên tử lớn hơn và điện tích hạt nhân nhỏ hơn các nguyên tố phi kim.
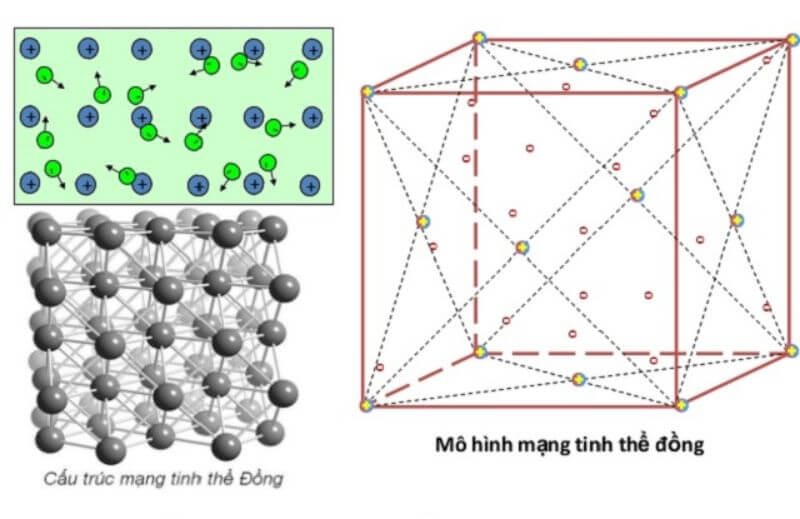
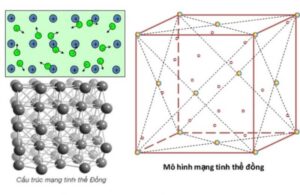
Cấu trúc tinh thể
Ở nhiệt độ thường, ngoại trừ thủy ngân ở thể lỏng, các kim loại khác đều ở thể rắn và có cấu trúc tinh thể
Trong tinh thể kim loại, các nguyên tử và ion kim loại nằm ở các nút của mạng tinh thể. Các electron hóa trị liên kết yếu với hạt nhân nên dễ dàng tách ra khỏi nguyên tử và chuyển động tự do trong mạng tinh thể.
Tinh thể kim loại có ba loại mạng phổ biến: mạng tinh thể lục giác, mạng tinh thể lập phương tâm mặt và mạng tinh thể lập phương tâm khối.
Hình 3: Kết cấu kim loại
2.2. Nhóm kim loại
- Kim loại cơ bản: Những kim loại này sẽ dễ phản ứng với môi trường bên ngoài gây ra hiện tượng oxy hóa và ăn mòn. Ngoài ra, một số kim loại cơ bản như kẽm (Zn), sắt (Fe),… có phản ứng hóa học với axit clohydric loãng (HCI). Đặc biệt Đồng (Cu) rất dễ bị oxy hóa mặc dù không phản ứng hóa học với HCl nên cũng được xếp vào loại kim loại cơ bản.
- Kim loại hiếm: Nhóm kim loại hiếm (Vàng (Au), Bạc (Ag), Bạch kim,…) ít bị ăn mòn bởi axit và oxy. Đồng thời, so với các kim loại khác, giá trị của chúng cũng cao hơn rất nhiều.
- Kim loại màu: Là những kim loại có từ tính và chứa sắt (Fe) như thép, gang và các hợp kim khác từ sắt. Nó được tạo thành từ hai yếu tố chính: carbon © và Sắt (Fe). Mặc dù kim loại màu có tính linh hoạt và độ bền cao trong tạo hình nhưng vì có chứa sắt nên dễ bị rỉ sét.
Hình 4: Các loại kim loại
- Kim loại màu: Là những kim loại còn lại không bao gồm kim loại đen. Chúng không phải là sắt hoặc hợp kim sắt. Có những đặc tính riêng và được sử dụng trong sản xuất từ quặng màu thứ cấp hoặc màu sơ cấp. Khả năng chống ăn mòn, dẫn nhiệt và dẫn điện của kim loại màu khá tốt.
3. Vai trò của kim loại đối với đời sống con người
Kim loại xuất hiện trong cuộc sống hoặc trong các ngành công nghiệp khác nhau. Bởi vì nó là vật liệu trong các công trình xây dựng và chế tạo máy móc. Sự phát triển của vật liệu kim loại sẽ đi đôi với sự phát triển không ngừng của các loại máy công cụ, máy móc độc lập với tính năng ngày càng cao.

Hình 5: Vai trò của kim loại
Đối với chúng ta, kim loại là một loại vật liệu hữu ích và vô cùng cần thiết. Nhờ sự tiến bộ và trình độ của con người, kim loại có nhiều ưu điểm hơn và ngày càng hiện diện trong từng lĩnh vực, mục đích.
Từ những thông tin trong bài viết này, bạn đã hiểu rõ hơn tính chất hóa học điển hình của kim loại là gì chưa? Hy vọng nó sẽ giúp ích cho các bạn khi ứng dụng kim loại vào cuộc sống.


Nội dung được phát triển bởi đội ngũ truongchuvananhue.edu.vn với mục đích chia sẻ và tăng trải nghiệm khách hàng. Mọi ý kiến đóng góp xin vui lòng liên hệ tổng đài chăm sóc: 1900 0000 hoặc email: hotro@truongchuvananhue.edu.vn