Nội dung bài viết
Electron là thuật ngữ được nhắc đến rất nhiều nhưng không phải ai cũng hiểu rõ về nó. Đây là loại hạt ở lớp vỏ ngoài của nguyên tử có cấu trúc và khối lượng đặc trưng. Trong bài viết hôm nay Trường Chu Văn An sẽ phân tích chi tiết về Electron cũng như khối lượng E để các bạn tham khảo và hiểu rõ hơn về vấn đề này.
1. Electron là gì?
Trước khi tìm hiểu về khối lượng E chúng ta cùng tìm hiểu hạt Electron. Hạt electron còn được gọi với nhiều tên gọi khác như: Hạt hạ nguyên tử, electron, hạt hạ nguyên tử. Chúng có ký hiệu E. Điện tích của E tương đương với – 1,6 x 10-19.
Các electron có trọng lượng chỉ xấp xỉ 1/1836 lần trọng lượng của proton tích điện dương. Đây là hạt tích điện âm bao quanh hạt nhân có vai trò quan trọng liên quan đến nhiệt điện, hóa học, từ tính và độ dẫn điện.

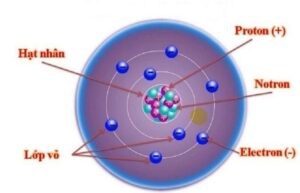
Tìm hiểu về Electron
2. Đặc tính của electron
E có tính chất sóng hạt: Tính chất nổi bật của E là tính chất sóng hạt. Chúng thể hiện cả tính chất hạt và sóng. Ví dụ cụ thể như sau: Electron vừa có thể phát ra như hạt vật chất, vừa có thể va chạm hoặc khúc xạ – giao thoa như sóng ánh sáng.
Khối lượng rất nhỏ E: Khối lượng E rất nhỏ tương đương với 9,1094,10-31 kg. Do đó, các hiệu ứng cơ học có thể ảnh hưởng đến E như hiệu ứng Compton hay nguyên lý bất định Heisenberg.
E có tính dẫn điện: Tính dẫn điện của E nằm ở khả năng di chuyển. Điều này được thể hiện như sau: Khi có điện trường ngoài tác dụng, vật liệu có thể chuyển động. Tùy thuộc vào chuyển động của các electron tự do hoặc lượng E mà vật liệu có độ dẫn điện khác nhau.
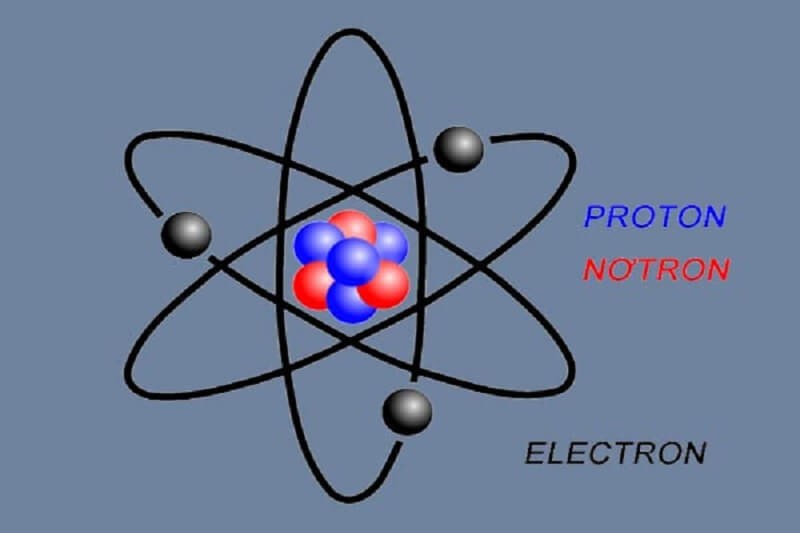
Khối lượng E rất nhỏ và có tính dẫn điện, tính chất sóng-hạt
Electron có spin: Spin là đại lượng từ. Chúng có hai giá trị bao gồm -1/2 hoặc +1/2. Đây là một bộ định lượng mang lại cho thuộc tính một liên kết cộng hóa trị hoặc từ tính.
Electron có lưỡng cực từ: Khả năng hình thành từ trường xung quanh nó là một trong những tính chất thể hiện lưỡng cực của Electron. Đây là sự kết hợp giữa quỹ đạo và chuyển động quay.
3. Cấu trúc và khối lượng của E
Các electron không có cấu trúc bên trong theo thành phần. Bởi vì chúng không có khả năng giãn nở ra không gian mà chỉ là một hạt điểm với các hạt điểm. Con người không thể nhìn thấy chúng bằng mắt thường vì chúng được chứa trong vật chất và có kích thước rất nhỏ.
Trong khi đó, cấu tạo của hạt nhân nguyên tử bao gồm lớp vỏ và hạt nhân có kích thước khoảng 0,1nm, tương đương 10-10m. Cụ thể:
3.1. Vỏ ngoài
Đây là các Electron tích điện âm, được sắp xếp thành từng lớp. Mỗi lớp sẽ có một số lượng E nhất định và chúng quay quanh không gian hạt nhân.
Những hạt E này rất nhẹ và thường bị hút bởi các hạt Proton tích điện dương. Số lượng electron luôn bằng số lượng proton trung hòa về điện.
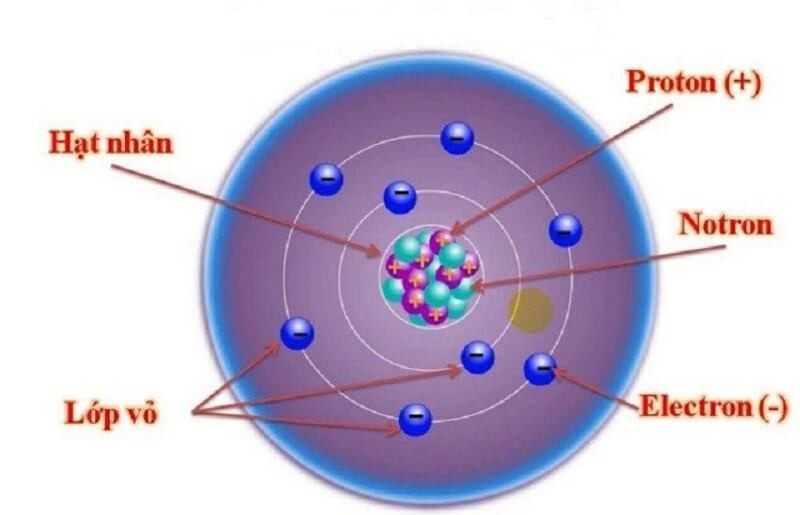
Lớp vỏ ngoài của nguyên tử được tạo thành từ các electron mang điện tích âm
3.2. Hạt nhân
Hạt nhân nằm ở giữa. Hạt nhân có kích thước gấp 10-5 – 10-4 lần kích thước nguyên tử. Hạt nhân bao gồm các hạt Proton và hạt neutron có những đặc điểm sau:
- Hạt proton ký hiệu P, mang điện tích dương. Chúng có khối lượng 1,6726,10-27kg, có điện tích +1,602,10-19C.
- Các hạt neutron ký hiệu là N, mang điện tích trung tính. Chúng có khối lượng 1,6748,10-27kg và điện tích bằng 0.
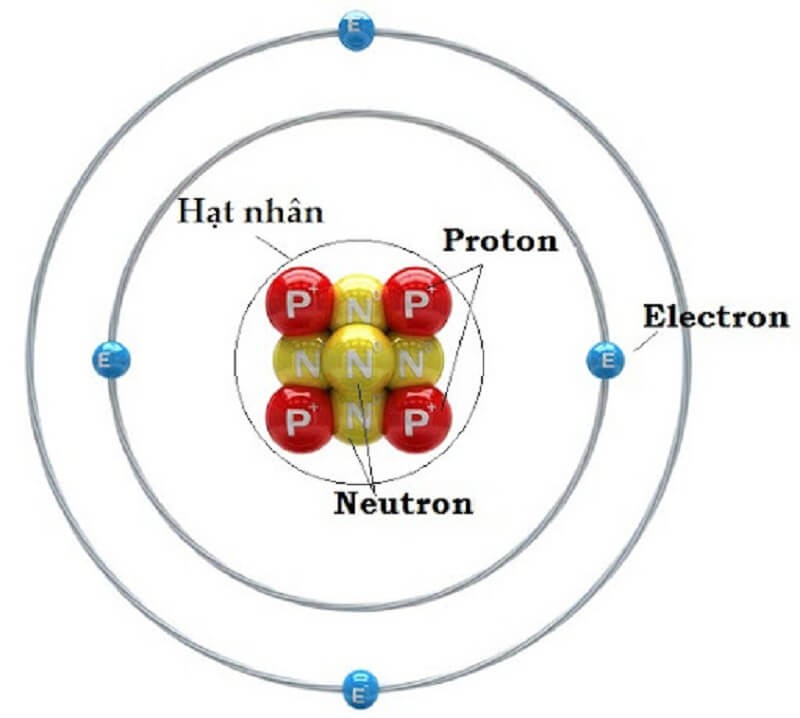
Cấu tạo của nguyên tử gồm có lớp vỏ và hạt nhân
4. Cách viết cấu hình Electron
Khối lượng của E là bao nhiêu đã được phân tích khá chi tiết ở trên. Ngoài ra, cấu hình E viết khá đơn giản theo hướng dẫn từng bước dưới đây:
- Bước 1: Xác định số Electron của nguyên tử dựa vào bảng tuần hoàn các nguyên tố hóa học.
- Bước 2: Phân bố E tăng dần khi năng lượng AO tăng dần. Đây là một bước quan trọng dựa trên nguyên tắc Hund và nguyên tắc Pauli.
- Bước 3: Tiến hành viết cấu hình E theo lớp trong 1 lớp. Đồng thời viết theo thứ tự từng lớp Electron.
- Bước 4: Cô đọng nội dung trên.
Ví dụ: Nguyên tử Zn trong bảng tuần hoàn các nguyên tố hóa học có Z = 30.
Khi đó: Số Electron của Zn là 30e được phân bố như sau: 1s22s22p63s23p64s23d10.
Lớp 3d10 và 4s2 được chèn năng lượng của nhau nên có thể viết là: 1s22s22p63s23p63d104s2. Sau đó viết tắt là [Ar] 3d104s2. Trong đó, [Ar] là viết tắt của cấu hình E của nguyên tố Argon.
5. Bài tập tập E
Từ các lý thuyết trên, các bạn có thể tham khảo một số bài tập về khối lượng E và cách giải dưới đây:
Bài tập 1: So sánh Magiê với Carbon. Nguyên tử nào nặng hơn và nặng hơn bao nhiêu lần?
Trả lời: Khối lượng nguyên tử của Mg và Carbon lần lượt là 24 đơn vị và 12 đơn vị. Do đó, nguyên tử Magiê nặng gấp 2 lần nguyên tử Carbon.
Bài tập 2: Khối lượng nguyên tử A gấp 4 lần nguyên tử nitơ. Vậy khối lượng nguyên tử của A là bao nhiêu và A là nguyên tố nào?
Trả lời: Nitơ có khối lượng nguyên tử là 14 đơn vị. Do đó khối lượng nguyên tử của A sẽ là:
14 x 2 = 56 đơn vị. Vậy A là Fe – sắt.
Electron xuất hiện trong nhiều hiện tượng tự nhiên và được sử dụng phổ biến trong công nghệ khoa học kỹ thuật. Hy vọng những chia sẻ của Trường Chu Văn An sẽ giúp các bạn hiểu rõ hơn về mass E và một số thông tin liên quan. Từ đó, bạn sẽ biết cách giải các bài tập về Electron và giải đáp các vấn đề mà bạn quan tâm.



Nội dung được phát triển bởi đội ngũ truongchuvananhue.edu.vn với mục đích chia sẻ và tăng trải nghiệm khách hàng. Mọi ý kiến đóng góp xin vui lòng liên hệ tổng đài chăm sóc: 1900 0000 hoặc email: hotro@truongchuvananhue.edu.vn