Nội dung bài viết
Trong môn hóa học lớp 10, cấu trúc nguyên tử là một phần kiến thức vô cùng quan trọng. Biết cấu tạo nguyên tử là gì? Các mô hình, sơ đồ cấu trúc sẽ giúp học sinh vận dụng tốt nhất vào bài tập của mình. Hãy cùng vietchem tìm hiểu về nguyên tử trong bài viết dưới đây nhé.
1. Cấu tạo của nguyên tử là gì?
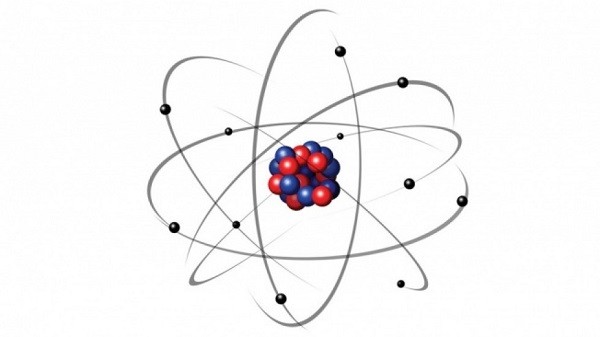
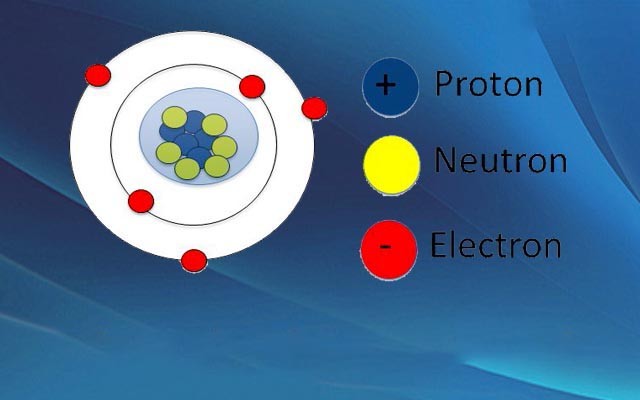
Hình ảnh cấu tạo vỏ nguyên tử trong hóa học
1.1. Nguyên tử là gì?
Nguyên tử là đơn vị cơ bản của vật chất, bao gồm các hạt cực nhỏ và trung hòa về điện. Nguyên tử bao gồm một hạt nhân ở trung tâm và được bao quanh bởi một đám mây electron mang điện tích âm.
Các nguyên tử thường có kích thước rất nhỏ, đường kính chỉ vài phần mười nanomet. Ký hiệu của nguyên tử là Z (Zahl trong tiếng Đức).
1.2. Các thành phần của một nguyên tử là gì?
Cấu trúc nguyên tử gồm 2 lớp: vỏ nguyên tử và hạt nhân
- Vỏ nguyên tử là các electron mang điện tích âm
- Các hạt nguyên tử là các hạt tích điện dương gọi là proton và không mang neutron.
Như vậy, cấu trúc nguyên tử bao gồm ba loại hạt: electron, proton và neutron. Trong đó số electron bằng số proton, trọng lượng 1 proto = 1800 electron. Tùy thuộc vào các điều kiện vật lý như mật độ, nhiệt độ và áp suất, nó sẽ dẫn đến sự chuyển pha vật chất giữa rắn, lỏng, khí và plasma.
|
Hạt giống |
Điện tích |
Âm lượng |
|
proton |
qp = – 1,602 x 10–19 C |
mp = 1,6726,10-27kg |
|
neutron |
qn = 0 |
mn = 1,6726,10-27kg |
|
điện tử |
qe = – 1,602 x 10-19 C |
tôi = 9,1094 x 10-31 kg |
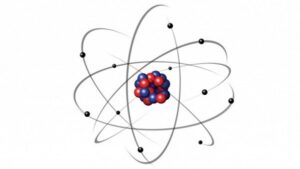
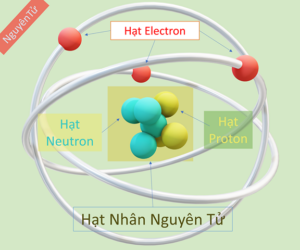
2. Mô hình cấu trúc nguyên tử
Sơ đồ tư duy cấu trúc nguyên tử bao gồm lớp vỏ và hạt nhân liên kết với nhau bằng các hạt mang điện (+) và các hạt không mang điện. Có những hạt nhận electron và những hạt cho electron, tạo ra liên kết nguyên tử vững chắc.
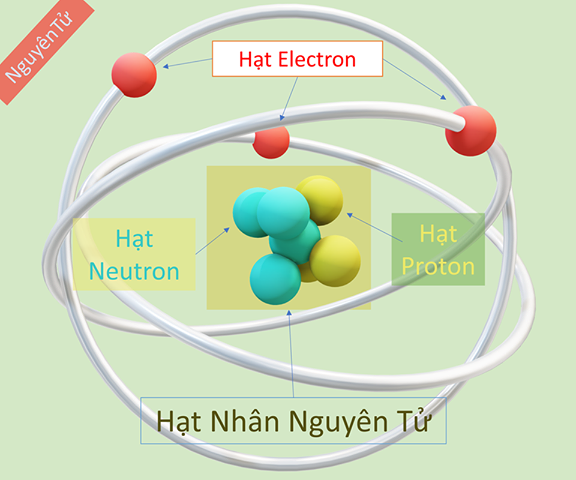
Mô hình cấu trúc nguyên tử bao gồm những hạt nào (p, e, n)?
>>>XEM THÊM: Cấu trúc nguyên tử dưới dạng điện – Bài tập có giải thích chi tiết
Cấu trúc nguyên tử dưới dạng điện – Bài tập có giải thích chi tiết
3. Kích thước và khối lượng cấu tạo nguyên tử
3.1. Kích cỡ
- Nguyên tử có kích thước cực kỳ nhỏ, đường kính nguyên tử khoảng 10-10 m và hạt nhân khoảng 10-14 m.
- Đơn vị đo kích thước nguyên tử là angtron (1Å = 10-10m) hoặc nanomet (1nm = 10-9m)
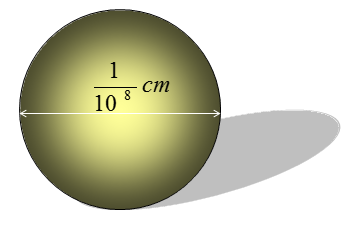
Đường kính của nguyên tử khoảng 10-10 m và đường kính của hạt nhân khoảng 10-14 m
3.2. Khối lượng nguyên tử
Khối lượng của nguyên tử tập trung chủ yếu ở hạt nhân nên khối lượng nguyên tử còn được gọi là khối lượng hạt nhân với ký hiệu đơn vị là u(đơn vị).
Giá trị 1u(đơn vị) = 1/12 khối lượng của 1 nguyên tử cacbon. Trong đó: Khối lượng nguyên tử cacbon = 19,9265,10-27kg => 1u = 19,9265,10-27kg /12 = 1,6605,10-27kg
4. Sự khác biệt giữa phân tử và nguyên tử
Sau khi hiểu được thành phần nguyên tử là gì, chúng ta có thể so sánh sự khác biệt giữa nguyên tử và phân tử thông qua số liệu sau:
|
đặc trưng |
nguyên tử |
Phân tử |
|
Ý tưởng |
Nguyên tử là đơn vị cơ bản của vật chất, bao gồm các hạt cực nhỏ và trung hòa về điện. Nguyên tử bao gồm một hạt nhân ở trung tâm và được bao quanh bởi một đám mây electron mang điện tích âm. |
Các phân tử bao gồm một số nguyên tử liên kết với nhau và thể hiện các tính chất hóa học hoàn chỉnh của một chất. |
|
Ví dụ |
Nguyên tử hydro, nguyên tử cacbon |
Ôxi (O2), nước (H2O) |
|
Hình dạng |
hình cầu |
Nhiều hình dạng |
|
Thiên nhiên |
Nguyên tử không thể chia thành hai |
Các phân tử có thể tách các nguyên tố và kết hợp chúng lại với nhau |
|
Hiện hữu |
Có thể tồn tại hoặc không tồn tại ở trạng thái tự do |
Tồn tại trong trạng thái tự do |
|
Kiểm tra bên ngoài |
Mắt thường không thể nhìn thấy |
Nó không thể nhìn thấy bằng mắt thường nhưng có thể nhìn thấy qua kính hiển vi |
|
liên kết |
Hạt nhân |
Cộng hóa trị, cộng ion |
5. Phân loại electron trong cấu trúc nguyên tử
5.1. Lớp e là gì?
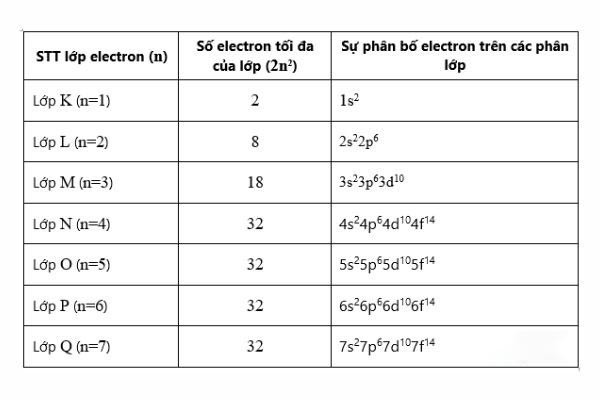
Trong cấu trúc nguyên tử, lớp e là các electron có mức năng lượng gần bằng nhau, sắp xếp theo thứ tự tăng dần từ mức năng lượng thấp đến mức năng lượng cao và được chia thành 7 lớp.
|
Mức năng lượng n |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
Tên lớp |
K |
L |
M |
N |
ồ |
P |
Q |
Bảng thống kê số electron tối đa trong mỗi lớp
5.2. Lớp con e
Lớp e có 4 lớp con: s, p, d, f và bao gồm các electron có mức năng lượng bằng nhau.
|
Phân loại |
S |
P |
d |
f |
|
Số lượng tối đa của e |
2 |
6 |
10 |
14 |
|
Biểu tượng |
s2 |
p6 |
d10 |
f14 |
6. Bài tập về cấu tạo nguyên tử gồm những loại bài tập nào?
Có 3 dạng bài tập về nguyên tử thường gặp trong sách giáo khoa, đề thi học kỳ và đề thi môn hóa đại học mà học sinh thường gặp. Hiểu được lý thuyết phần này sẽ giúp bạn giải các bài tập nguyên tử, hạt nhân dễ dàng hơn.

Các dạng bài tập về nguyên tử trong hóa học
6.1. Xác định các yếu tố
Dựa vào số Z của nguyên tử để xác định nguyên tố hóa học này là gì
- Z=p=e=E
- Số khối A = Z + N
- Tổng số hạt tích điện là = Z + E = 2Z
- Tổng số hạt là = 2Z + N
6.2. Nêu cấu trúc nguyên tử
– Cách 1: Lập phương trình dựa vào cấu tạo của lớp vỏ nguyên tử và lớp vỏ ion, sau đó giải tìm số hạt.
– Cách 2: Dựa vào ký hiệu của nguyên tử rồi suy ra số lượng hạt của từng loại nguyên tử
M → Mn + ne (sản lượng e)
(nhận e) X + me → Xm-
6.3. Viết cấu hình e
Bước 1: Xác định số lượng electron trong nguyên tử
Bước 2: Phân bố các electron theo mức năng lượng tăng dần
Bước 3: Viết cấu hình các electron theo thứ tự các lớp electron trong cùng một lớp
7. Bài tập thực hành về cấu tạo nguyên tử
Sau khi nắm vững lý thuyết và bài tập về cấu tạo nguyên tử, chúng ta sẽ luyện tập một số bài tập trong sách giáo khoa hóa học lớp 10 để giúp các em củng cố kiến thức.
Giải bài tập nguyên tử hóa học lớp 10
Bài tập 1: Cấu trúc nguyên tử của lớp hạt nhân gồm những loại hạt nào?
A: electron, proton và neutron
- electron và neutron
- proton và neutron
- electron và proton
Giải: Đáp án C
Bài tập 2: Các hạt tích điện dương có cấu tạo nguyên tử và liên kết hóa học là:
- electron và proton
- proton
- proton và neutron
- neutron
Giải: Đáp án B
Bài tập 3: Khối lượng của nguyên tử cacbon -12 là bao nhiêu?
- 1u
- 12 gram
- 1 đơn vị
- 12u
Giải: Đáp án D
Bài 4: Hạt nhân X có tổng số hạt cơ bản là 40, tổng số hạt tích điện nhiều hơn số hạt không tích điện là 12 hạt. Vậy hạt nhân X có bao nhiêu hạt?
Giải pháp:
Trong số hiệu nguyên tử p=e thì tổng số hạt sẽ được tính là: 2P + N=40
Số hạt tích điện nhiều hơn số hạt không tích điện 12 => 2P – N = 12
Giải phương trình ta thu được: P = 13 và N = 14 => Hạt nhân X có số hạt P + N = 27 hạt
Bài 5: X có tổng số hạt cơ bản là 18. Tính số hạt tích điện dương trong X
Giải pháp:
Theo lý thuyết: Với các phần tử có Z < 82 thì ta luôn có: 1 ≤ Z/N ≤ 1,5.
Theo bài toán ta có 2Z + N = 18
Bởi vì Z < 82, we have 1 ≤ Z/N ≤ 1.5 ⇒ Z ≤ N ≤1.5Z => 5,11 Z 6
Trong đó Z luôn nguyên => Z = 6
Kết luận: Số hạt tích điện dương trong X là 6 hạt
Bài 6: Canxi kim loại có khối lượng riêng là 1,55 g/cm3. Nếu trong tinh thể canxi các nguyên tử có dạng hình cầu, chiếm 74% thể tích tinh thể, phần còn lại là rỗng thì NTK của Ca là 40 đơn vị. Tính bán kính nguyên tử canxi.
Giải pháp:
– Ta có 1cm3 tinh thể canxi có khối lượng 1,55 gam, tổng thể tích nguyên tử canxi là 0,74cm3
– 1,55 gam canxi tương ứng với 0,03875 mol hoặc 2,325,1022 nguyên tử.
– Thể tích của 1 nguyên tử canxi là 3,18 x 10-23 cm3. Xét rằng nguyên tử có dạng hình cầu, bán kính của nguyên tử canxi là 1,96 x 10-8 cm hoặc 0,196 nm.
Hiểu các thành phần cấu trúc nguyên tử Những gì đi kèm sẽ giúp bạn có thêm lý thuyết và áp dụng vào bài tập để có kết quả chính xác nhất. Tham khảo các dạng bài tập hóa học khác trên website vietchem.com.vn.


Nội dung được phát triển bởi đội ngũ truongchuvananhue.edu.vn với mục đích chia sẻ và tăng trải nghiệm khách hàng. Mọi ý kiến đóng góp xin vui lòng liên hệ tổng đài chăm sóc: 1900 0000 hoặc email: hotro@truongchuvananhue.edu.vn