Nội dung bài viết
Ngoài amoniac, muối amoni đóng vai trò quan trọng trong hệ thống hợp chất nitơ. Hãy cùng tìm hiểu về các tính chất lý hóa, chế phẩm, ứng dụng trong đời sống và một số bài tập thực tế qua bài viết dưới đây.
1. Muối amoni là gì?
Muối amoni là các tinh thể ion bao gồm cation amoni NH4+ và anion axit
Công thức muối amoni: (NH4)nA
Một số loại muối amoni
- Muối amoni của axit hữu cơ: HCOONH3CH3, CH3COOH3NCH3, CH3COONH4, HCOONH4
- Muối amoni của axit vô cơ: CH3NH3NO3, C6H5NH3Cl, CH3NH3HCO3, (CH3NH3)2CO3
Ví dụ: Amoni Nitrat (NH4NO3), Amoni clorua (NH4Cl), Amoni sunfat ((NH4)2SO4)

Hình 1: Muối amoni sunfat
2. Tính chất vật lý của muối amoni
Tất cả các muối amoni đều hòa tan cao trong nước và phân ly hoàn toàn thành các ion khi hòa tan. Ion NH4+ không có màu
3. Tính chất hóa học của muối amoni
3.1. Muối amoni phản ứng với dung dịch kiềm
Đây cũng là một cách để xác định muối amoni. Dung dịch muối amoni đậm đặc phản ứng với dung dịch kiềm khi đun nóng sẽ thoát ra khí amoniac có mùi hôi.
Ví dụ:
(NH4)2SO4 + 2NaOH -> 2NH3 + 2H2O + Na2SO4 (trong điều kiện nhiệt độ)
Phương trình khi đơn giản hóa:
NH4+ + OH- -> NH3 (bay hơi) + H2O
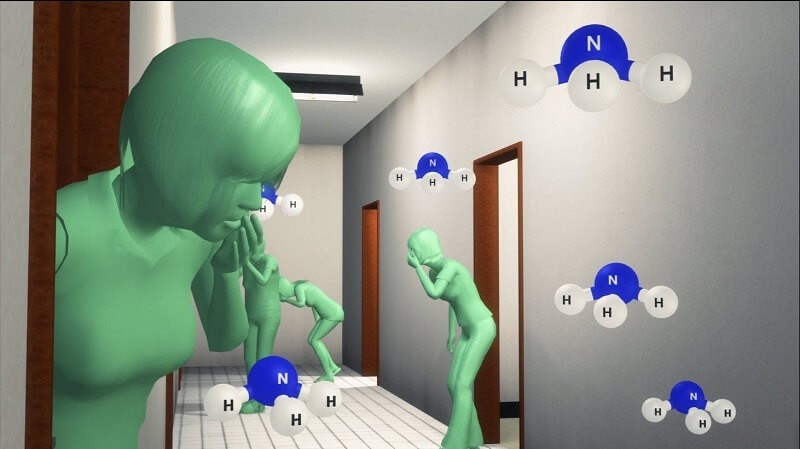
Hình 2: Nhận biết muối amoni phản ứng với dung dịch kiềm
3.2. Phản ứng nhiệt phân muối amoni
- Muối amoni chứa axit không oxy hóa, phân hủy thành amoniac khi đun nóng
Ví dụ: nhiệt phân muối NH4Cl
NH4Cl -> NH3 + HCl (điều kiện nhiệt độ)
Khi đun nóng trong ống nghiệm, tinh thể NH4Cl sẽ phân hủy thành khí NH3 và khí HCl. Khi tăng lên gặp nhiệt độ thấp hơn, hai khí này sẽ kết hợp với nhau tạo thành tinh thể NH4Cl màu trắng
Ví dụ, quá trình nhiệt phân muối amoni cacbonat và muối amoni hydrocacbonat phân hủy chậm ngay cả ở nhiệt độ thường, phản ứng giải phóng khí NH3 và CO2, trong điều kiện đun nóng phản ứng diễn ra nhanh hơn:
NH4HCO3 -> NH3 + CO2 + H2O
(NH4)2CO3 -> NH3 + NH4HCO3
- Nhiệt phân muối amoni chứa các gốc axit oxy hóa như axit nitơ và axit nitric tạo ra N2 và N2O.
Ví dụ:
NH4NO3 -> N2O + 2H2O
NH4NO2 -> N2 + 2H2O
Đây là phương trình điều chế khí N2 và N2O trong phòng thí nghiệm
>>> Xem thêm Khí amoniac (NH3) 99%
4. Ứng dụng của muối amoni trong đời sống
- Trong y học: Muối amoni đôi khi được sử dụng như một phần của dung dịch làm sạch vết thương hoặc làm mát cơ thể trong trường hợp khẩn cấp.
- Trong hóa học, công nghiệp: Là chất phân tích trong phòng thí nghiệm, dùng trong làm sạch kim loại, sản xuất thuốc nhuộm, làm tinh thể giảm ẩm trong quá trình hàn và trong sản xuất pin điện hóa học
- Trong thực phẩm: Một số muối amoni được dùng làm chất tạo chua hoặc tăng độ chua cho thực phẩm
- Trong nông nghiệp: Có thể dùng để điều chỉnh độ pH của đất trong quá trình canh tác cây trồng

Hình 3: Amoni clorua là loại phân bón trong nông nghiệp
- Trong sản xuất sữa bột: Muối amoni được sử dụng để tạo mùi khói cần thiết trong quá trình sản xuất sữa bột
5. Điều chế muối amoni
Điều chế muối amoni bằng cách cho NH3 phản ứng với axit trong phản ứng trao đổi ion
6. Tác dụng của muối amoni
Mặc dù NH4+ không quá độc hại đối với sức khỏe và môi trường nhưng khi có trong nguồn nước với nồng độ vượt tiêu chuẩn cho phép, muối amoni có thể làm biến đổi chất và gây ra các bệnh nguy hiểm, đặc biệt là ung thư.
Nghiên cứu cho thấy cứ 1g amoni khi chuyển hóa hoàn toàn có thể tạo ra 2,7g nitrit và 3,65g nitrat, vượt hàm lượng cho phép là 0,1mg/lít và 10-50mg/lít.
Muối amoni thường xuất hiện trong nước thải do chúng được tạo ra từ quá trình phân hủy các chất hữu cơ như protein, gây ô nhiễm nguồn nước và gây nguy hiểm cho sức khỏe con người cũng như động thực vật xung quanh nếu không được xử lý cẩn thận.
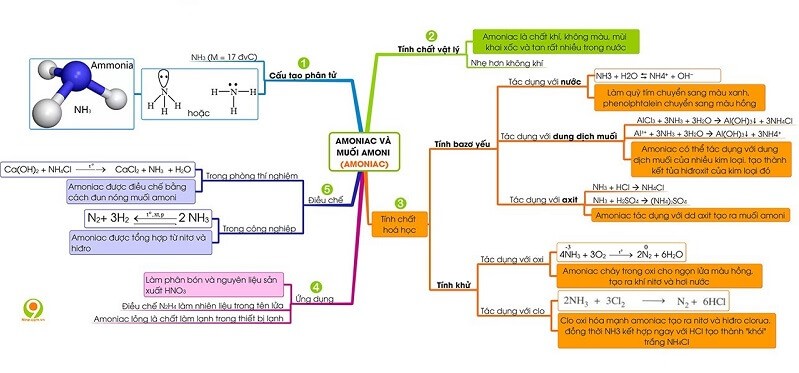
7. Sơ đồ tư duy về amoniac và muối amoni
8. Bài tập muối amoni
Câu hỏi 1. Nguyên tố nitơ có số oxi hóa trong các hợp chất lần lượt là NH3, NH4Cl
- -3 và +3.
- -3 và +4.
- -3 và +5.
- -3 và -3.
Giải pháp:
Đáp án D
Gọi số oxi hóa của NH3 là x
– NH3: x + (+1).3 = 0 → x = -3.
– NH4Cl: x + (+1).4 = -1 → x = -3.
Câu hỏi 2. Không khí trong phòng thí nghiệm bị ô nhiễm khí clo. Để khử trùng, dung dịch nào sau đây có thể được phun vào không khí?
A. Dung dịch NaOH.
B. Dung dịch NH3.
C. Dung dịch NaCl.
D. Pha loãng dung dịch H2SO4.
Giải pháp:
đáp án B
Cl2 oxy hóa mạnh amoniac tạo thành N2 và HCl.
2NH3 + 3Cl2 → N2 + 6HCl.
Câu hỏi 3. Nhận xét đúng về muối amoni là:
- Muối amoni là tinh thể ion, phân tử bao gồm cation amoni và anion hydroxit.
- Tất cả các muối amoni đều dễ hòa tan trong nước và khi hòa tan điện phân, chúng hoàn toàn tạo thành cation amoni và anion axit.
- Dung dịch muối amoni phản ứng với dung dịch kiềm đậm đặc, nóng để giải phóng khí làm quỳ tím chuyển sang màu đỏ.
- Khi nhiệt phân muối amoni, khí amoniac luôn thoát ra.
Giải pháp:
Đáp án B
Câu hỏi 4. Chất nào sau đây có thể dùng để trung hòa amoniac?
- Giấm.
- Muối ăn.
- nước ngọt
- Vôi clorua.
Giải pháp:
Đáp án A
CH3COOH + NH3 → CH3COONH4.
Câu hỏi 5. Phát biểu sai là
- Các muối amoni đều tan trong nước.
- Muối amoni khi tan trong nước phân ly hoàn toàn thành ion.
- Muối amoni khi đun nóng sẽ phân hủy thành amoniac và các axit tương ứng.
- Muối amoni có thể được sử dụng để điều chế NH3 trong phòng thí nghiệm.
Giải pháp:
Đáp án C
Câu hỏi 6. Dung dịch amoniac có tính bazơ vì
- Amoniac tan nhiều trong nước.
- Phân tử amoniac là một phân tử phân cực.
- Khi hòa tan trong nước, amoniac kết hợp với nước tạo thành ion NH4+ và H3O+.
- Khi hòa tan trong nước, các phân tử amoniac kết hợp với ion H+ của nước tạo thành ion NH4+ và OH-.
Giải pháp:
Đáp án D
Câu hỏi 7. Hiện tượng thu được khi muối amoni phản ứng với dung dịch kiềm là
- Một chất khí màu xanh nhạt thoát ra.
- Có khí không màu, mùi hắc thoát ra làm giấy quỳ ẩm chuyển sang màu xanh.
- Có khí màu nâu đỏ thoát ra làm giấy quỳ ẩm có màu xanh.
- Thoát ra khí không màu, không mùi.
Giải pháp:
đáp án B
NH4+ + OH- → NH3 ↑ + H2O
Khí NH3 không màu, có mùi mạnh, làm quỳ tím ẩm chuyển sang màu xanh.
Câu hỏi 8. Ý kiến đó là đúng
- Muối amoni chứa axit oxy hóa không bị nhiệt phân.
- Dung dịch NH3 hòa tan Zn(OH)2 vì Zn(OH)2 là chất lưỡng tính.
- Muối amoni dễ bị phân hủy bởi nhiệt.
- Khí amoniac làm hải quỳ đỏ tím và ẩm ướt.
Giải pháp:
Đáp án C
A sai vì muối amoni dễ bị nhiệt phân.
B sai vì dung dịch NH3 hòa tan Zn(OH)2 vì nó có thể tạo thành phức chất hòa tan.
D sai vì khí amoniac làm giấy quỳ ẩm chuyển sang màu xanh.
9. Những câu hỏi thường gặp về muối amoni
(1) Muối amoni có bền với nhiệt không?
Tất cả các muối amoni đều không bền với nhiệt
(2) Muối amoni là chất điện phân loại này
Tất cả các muối amoni đều là chất điện li mạnh
(3) Muối amoni là chất lưỡng tính, Đúng hay Sai?
Chính xác
(4) Tất cả các muối amoni đều tan trong nước, Đúng hay Sai?
Có, trong nước muối amoni, chất điện phân tạo ra hoàn toàn ion NH+ không màu và tạo môi trường bazơ
(5) Amoni gluconate là gì?
Amoni gluconate là muối amoni của axit gluconic, là một axit hữu cơ tự nhiên có nguồn gốc từ glucose khi nó trải qua quá trình oxy hóa bởi vi khuẩn hoặc enzyme. Amoni gluconate được tạo ra thông qua phản ứng trùng hợp axit gluconic và amoni
(6) Amoni trong nước thải là gì?
Amoni trong nước thải là dạng ion amoni (NH4+) có thể có trong nước thải từ nhiều nguồn khác nhau, bao gồm nước thải sinh hoạt, công nghiệp, nông nghiệp và các hoạt động khác. Được hình thành do quá trình phân hủy chất hữu cơ.
Trên đây là toàn bộ những thông tin về muối amoni mà Vietchem cung cấp cho bạn. Hy vọng những thông tin này sẽ hữu ích với các bạn, đừng quên theo dõi Vietchem để cập nhật những tin tức hóa chất mới nhất nhé.


Nội dung được phát triển bởi đội ngũ truongchuvananhue.edu.vn với mục đích chia sẻ và tăng trải nghiệm khách hàng. Mọi ý kiến đóng góp xin vui lòng liên hệ tổng đài chăm sóc: 1900 0000 hoặc email: hotro@truongchuvananhue.edu.vn