Nội dung bài viết
Amin là một nhóm các hợp chất hữu cơ quan trọng. Vậy amin là gì? Chia thành nhiều loại và những đặc tính tiêu biểu của chúng. Hãy cùng nhau tìm hiểu qua bài viết dưới đây nhé!
1. Amin là gì?
Amin là các hợp chất hữu cơ thay thế một hoặc nhiều nguyên tử hydro của phân tử amoniac (NH3). Vì vậy, N trong phân tử amin có thể liên kết với các nhóm chức khác như alkyl, nhóm chức chứa cacbon…
Amin tạo nên protein – phân tử cực kỳ quan trọng đối với các hoạt động sống của cơ thể.
2. Amin được chia thành mấy loại?
Có nhiều cách khác nhau để phân loại amin như:
– Sắp xếp theo nguồn gốc link:
- Amin thơm
- Amin béo:
- Amin dị vòng

Thứ tự amin
– Phân loại theo hàm lượng amin:
Trên cơ sở nguyên tử hydro được thay thế bằng phân tử amoniac, người ta chia amin thành 4 loại chính sau:
- Amin bậc một: Khi một trong các nguyên tử hydro của phân tử amoniac được thay thế bằng nhóm alkyl hoặc aryl. Ví dụ: Metylamin CH3NH2, Anilin C6H5NH2…
- Amin thứ cấp: Hai nhóm thế hữu cơ thay thế 2 nguyên tử hydro trong phân tử amoniac để tạo thành amin. Ví dụ: Dimetylamin (CH3)2NH, Diphenylamin (C6H5)2 NH
- Amin bậc ba: Khi cả 3 nguyên tử hydro được thay thế bằng 3 nhóm thế hữu cơ như nhóm aryl hoặc thơm. Ví dụ: Trimethylamine N(CH3)3, axit Ethyndiaminetetraacetic (EDTA)…
Ngoài ra, khi các amin liên kết với vòng benzen, chúng còn được gọi là amin thơm. Hợp chất đơn giản nhất của dãy amin thơm là anilin.
3. Cách gọi tên – danh pháp các amin
Amin có thể được gọi bằng nhiều tên khác nhau như sau:
3.1. Tên theo danh pháp gốc – chức vụ
Tên amin = tên bazơ alkyl + amin
Ví dụ:
- CH3NH2 = metyl + amin = metylamin
- C2H5NH2 = etyl + amin = etylamin
3.2. Tên theo danh pháp thay thế
Tên amin = tên bazơ alkyl + vị trí + amin
Ví dụ:
- CH3CH(NH2)CH3 = propan – 2 – amin
3.3. Tên chung
Ngoài những cái tên trên, amin còn được biết đến với những cái tên thông dụng như:
- C6H5NH2 = anilin
- C6H5NHCH3 = N-metylanilin
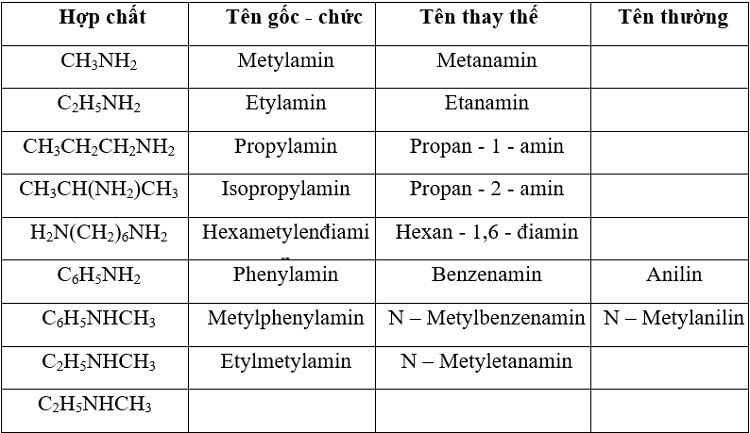
Danh pháp một số amin
4. Tính chất đặc trưng của amin
4.1. Tính chất vật lý
– Về trạng thái tồn tại: Các amin có khối lượng thấp như metylamin, etylamin là chất khí, có mùi giống mùi amoniac. Amin cao hơn là chất lỏng, một số là chất rắn.
Cũng cần lưu ý rằng các amin alkyl và các amin hydrocarbon tuyến tính thường dễ bay hơi, có mùi giống amoniac và rất độc. Chúng thường tồn tại trong thịt cá và đây cũng là nguyên nhân khiến thực phẩm có mùi ôi thiu. Vì vậy, để khử amin người ta thường dùng giấm hoặc chanh.
– Nhiệt độ sôi: Nhờ tính phân cực và sự có mặt của hydro liên phân tử nên chúng có nhiệt độ cao hơn các hydrocacbon tương ứng. Tuy nhiên, nhiệt độ sôi của chúng thấp hơn rượu.
– Độ hòa tan: Amin thấp tan tốt trong nước, amin cao ít tan hoặc không tan.
4.2. Tính chất hóa học
Tương tự như amoniac, amin thể hiện tính chất cơ bản vì nguyên tử nitơ của amin có các cặp electron đơn độc nên chúng có khả năng tặng các cặp electron để tạo thành bazơ. Tuy nhiên, đây là những căn cứ yếu.
– Khi nhúng vào giấy quỳ đỏ ẩm hoặc làm phenolphtalein chuyển sang màu hồng.
– Phản ứng với axit tạo muối amoni:
Vì amin là bazơ yếu nên các muối này dễ phản ứng với bazơ kiềm để giải phóng amin nên sẽ tiếp tục phản ứng:
– Phản ứng với axit nitơ (HNO2, nhưng không ổn định nên thường sử dụng hỗn hợp NaNO2 + HCl):
Amin bậc một:
C2H5-NH2 + HONO -> C2H5-OH + N2 + H2O (xúc tác HCl)
Amin bậc hai:
(CH3)2N-H + HONO → (CH3)2N-N=O + H2O
C6H5-NH-CH3 + HONO → C6H5-N2O-CH3 + H2O
Amin bậc ba:
- Amin bậc ba aliphatic không phản ứng với axit nitơ hoặc chỉ tạo thành muối không ổn định, dễ bị thủy phân
- Các amin bậc ba thơm phản ứng với axit nitơ để tạo ra các sản phẩm thay thế thơm. Ví dụ:
(CH3)2N-C6H5 + HONO → p-(CH3)2N-C6H4-NO + H2O (xúc tác axit HCl)
– Phản ứng thế thơm:
Các nhóm -NH2, -NHCH3… là các nhóm hoạt hóa vòng thơm và có tính định hướng cho các phản ứng thay thế xảy ra ở vị trí ortho và para.
- Halogen hóa: Anilin phản ứng với nước brom tạo thành kết tủa trắng 2,4,6-tribromoaniline
- Sulfat hóa: Đun nóng anilin với H2SO4 đậm đặc ở 180 độ C sẽ gây ra một loạt phản ứng, cuối cùng tạo thành axit sulfanilic
Ngoài ra, Amin còn tham gia phản ứng thế nguyên tử hydro của nhóm amino.
5. Ứng dụng của amin trong đời sống
Amin được sử dụng rộng rãi trong đời sống. Một số ứng dụng phổ biến của chúng như sau:
- Được sử dụng trong lọc nước, sản xuất thuốc và phát triển thuốc trừ sâu và thuốc trừ sâu.
- Trong các sinh vật sống, nó tham gia vào quá trình sản xuất axit amin – tạo nên các protein quan trọng. Ngoài ra, amin còn có thể tổng hợp thành vitamin.
- Các diamines được tổng hợp thành polyme.
- Thuốc giảm đau như Morphine và Demerol được làm từ amin.
- Dimethyl được dùng để sản xuất dung môi:
- Anilin được sử dụng rộng rãi trong công nghiệp nhuộm (sản phẩm azo, sản phẩm “đen anilin”,…), dược phẩm (antifebrin, streptoxide, sulfaguanidine,…), nhựa (aniline-formaldehyde,…). .. Toluidine và naphthylamine cũng được sử dụng trong sản xuất thuốc nhuộm
- Trong lĩnh vực sản xuất dược phẩm, hợp chất amin được sử dụng để điều trị nhiều bệnh khác nhau như amphetamine điều trị tăng huyết áp, chlorodiazepoxide có tác dụng an thần…

Amin dùng trong tổng hợp chất màu
Trên đây là những kiến thức cơ bản về amin. Nhờ những đặc tính độc đáo, amin được sử dụng trong nhiều ngành công nghiệp khác nhau để đáp ứng nhu cầu hàng ngày của con người.


Nội dung được phát triển bởi đội ngũ truongchuvananhue.edu.vn với mục đích chia sẻ và tăng trải nghiệm khách hàng. Mọi ý kiến đóng góp xin vui lòng liên hệ tổng đài chăm sóc: 1900 0000 hoặc email: hotro@truongchuvananhue.edu.vn