Nội dung bài viết
Clo là một nguyên tố hóa học vô cùng quen thuộc. Nó được sử dụng trong nhiều lĩnh vực của cuộc sống cũng như trong nghiên cứu và được biết đến nhiều nhất với đặc tính khử trùng. Vậy clo có những tính chất gì, ứng dụng cụ thể ra sao và các cách điều chế clo trong phòng thí nghiệm như thế nào? Hãy cùng vietchem tìm hiểu qua bài viết dưới đây nhé!

Clo là gì?
1. Clo là gì?
Clo là một nguyên tố halogen trong bảng tuần hoàn các nguyên tố hóa học, có ký hiệu Cl. Nó thuộc tế bào số 17, thuộc chu kỳ 3 và có số hiệu nguyên tử là 17. Ion clo là một trong những thành phần của natri clorua và nhiều hợp chất khác. Đây là chất quan trọng để tạo nên sự sống, trong đó có con người.
Trong tự nhiên, clo được tìm thấy nhiều trong nước biển, chiếm tới 1,94%. Muối biển Natri Clorua được tìm thấy ở trạng thái rắn gọi là muoosimor. Ngoài ra, kali clorua cũng khá phổ biến và nó xuất hiện trong các khoáng chất carbalite KCl.MgCl2.6H2O và cinvinite NaCl.KCl.

Clo tồn tại dưới dạng khí màu vàng nhạt, có mùi hăng, có tính oxy hóa mạnh và là thành phần quan trọng trong công nghiệp hóa chất, điển hình là các loại hóa chất khử trùng, tẩy trắng.
2. Tính chất hóa lý đặc trưng của Clo
2.1 Tính chất vật lý của clo
- Clo là chất khí, trong điều kiện bình thường nó tồn tại ở trạng thái khí, có màu vàng, mùi rất hăng, hăng và là một halogen cực độc.
- Khí clo nặng hơn không khí gần 2,5 lần, tan trong nước và tan trong dung môi hữu cơ.
- Trong tự nhiên, clo tồn tại ở dạng hợp chất muối clorua, đặc biệt trong muối ăn NaCl hoặc muối KCl. Ngoài ra, nó còn tồn tại trong một số khoáng chất như Carnalite hay xinvinite.
2.2 Tính chất hóa học của clo
Vì lớp electron ngoài cùng của Clo đã có sẵn 7e nên nó là một phi kim loại điển hình, dễ dàng nhận được 1e. Vì vậy nó có tính oxi hóa mạnh.
Cl2 + 2e → 2Cl- (ion clorua)
Khi ở trong hợp chất, clo thường có trạng thái oxy hóa -1, còn khi ở trong hợp chất với F hoặc O, clo cũng có trạng thái oxy hóa +1; +3; +5; +7.
Clo là chất oxi hóa mạnh. Ngoài ra, nó còn thể hiện tính chất khử trong một số trường hợp.
- Phản ứng với kim loại
Clo phản ứng với hầu hết các kim loại, ngoại trừ Au và Pt, tạo thành muối halogenua có hóa trị kim loại cao. Điều kiện để phản ứng xảy ra là đun nóng.
2Fe + 3Cl2 → 2FeCl3
- Phản ứng với hydro khi có ánh sáng
H2 + Cl2 → 2HCl
Nếu tỉ lệ mol của H2 và Cl2 là 1:1 thì sẽ tạo thành hỗn hợp dễ nổ.
- Phản ứng với nước
Clo có phản ứng thuận nghịch khi phản ứng với nước. Phản ứng hóa học xảy ra như sau:
H2O + Cl2 ↔ HCl + HClO (axit clohydric và axit hypoclorơ)
Do HClO có tính oxy hóa rất mạnh và có tính tẩy trắng cao nên nước clo thường được dùng làm chất tẩy màu, sát trùng, khử trùng cho nước.
- Phản ứng với dung dịch muối của halogen yếu hơn
Cl2 + 2NaBr → 2NaCl + Br2
Cl2 + 2KI → 2KCl + I2
- Phản ứng với các hợp chất khử
2FeCl2 + Cl2 → 2FeCl3
3Cl2 + 2NH3 → N2 + 6HCl
Trong phòng thí nghiệm, amoniac được dùng để khử độc khí clo trong phòng thí nghiệm
4Cl2 + H2S + 4H2O → 8HCl + H2SO4
3. Điều chế clo trong phòng thí nghiệm như thế nào?
Để điều chế clo trong phòng thí nghiệm, axit clohydric đậm đặc phản ứng với chất oxy hóa mạnh, có thể là mangan dioxide rắn hoặc kali penmanganat rắn, v.v. Nếu sử dụng mangan dioxide, cần phải xúc tác nhiệt độ, nhưng với kali penmanganat, nó có thể được đun nóng hoặc không được làm nóng. Do khí clo thu được sau phản ứng thường trộn lẫn với các tạp chất như khí hydro clorua và hơi nước nên để điều chế khí tinh khiết người vận hành sẽ cho khí đi qua máy rửa khí chứa dung dịch NaCl để giữ lại HCl và chứa H2SO4 đậm đặc để giữ hơi nước.
MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 6H2O
Trong công nghiệp, khí clo được điều chế bằng cách điện phân muối natri clorua nóng chảy.
2NaCl → 2Na + Cl2
Hoặc điện phân dung dịch muối bằng màng, theo phương trình phản ứng sau:
2NaCl + 2H2O → H2 + 2NaOH + Cl2
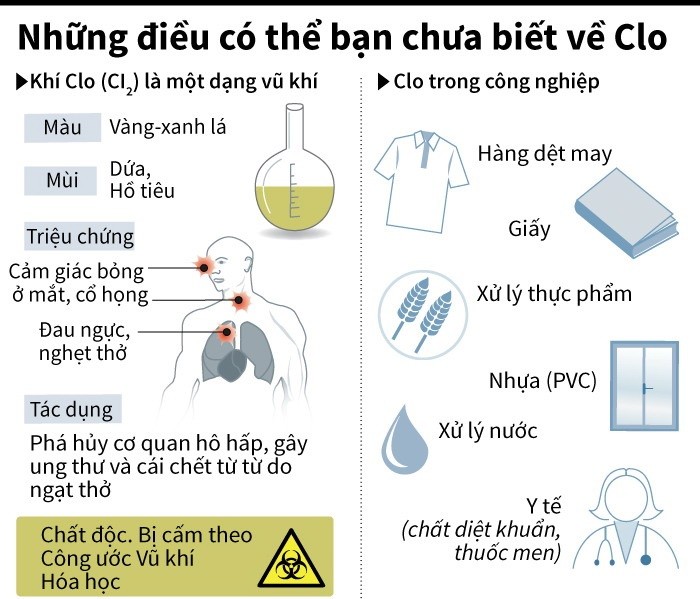
4. Những điều có thể bạn chưa biết về Clo
5. Vai trò của clo đối với sức khỏe con người
Bên cạnh tác dụng khử trùng, tẩy trắng, clo còn có những tác dụng nhất định đối với sức khỏe con người, cụ thể như sau:
Dành cho trẻ em
Clo trong cơ thể đóng vai trò như chất điện giải, giúp giữ nước, tránh tình trạng mệt mỏi, kiệt sức do thiếu nước. Đồng thời, clo còn giúp thúc đẩy sự phát triển cơ bắp, tăng sức mạnh và độ dẻo dai.
Dành cho người lớn
Hydro trong dạ dày khi kết hợp với clo sẽ tạo thành enzyme tiêu hóa mạnh có tác dụng phân hủy protein, giúp cơ thể hấp thụ tốt khoáng chất kim loại và vitamin B12. Khi clo được hấp thụ vào ruột và quay trở lại máu, nó giúp duy trì lượng chất lỏng trong cơ thể.
Vì clo mang điện tích âm nên sẽ kích thích khả năng thần kinh khi đi vào cơ thể, từ đó hạn chế và khắc phục đáng kể các bệnh về trí nhớ ở người lớn.
Đóng vai trò rất quan trọng, sự thay đổi lượng clo trong cơ thể sẽ gây ra những phản ứng bất thường. Nếu thiếu clo (do tiêu chảy, nôn mửa, đổ mồ hôi nhiều…), máu sẽ trở nên quá kiềm và cơ thể sẽ xuất hiện các triệu chứng như buồn nôn, mất nước, yếu cơ,… Nếu cơ thể thừa clo, thận sẽ đào thải clo qua nước tiểu. Tuy nhiên, nếu thận bị tổn thương và không hoạt động bình thường, clo sẽ tích tụ và có thể gây ung thư dạ dày.
Vì vậy, mỗi người cần thường xuyên theo dõi và kiểm soát lượng clo trong cơ thể.
Chắc chắn sau bài viết này của Vietchem bạn sẽ biết cách Chuẩn bị clo trong phòng thí nghiệm Nó thế nào rồi phải không? Nếu bạn đang có nhu cầu mua Clo hoặc nước Clo hãy liên hệ với chúng tôi theo số HOTLINE 0826 010 010 để được tư vấn và báo giá tốt nhất.


Nội dung được phát triển bởi đội ngũ truongchuvananhue.edu.vn với mục đích chia sẻ và tăng trải nghiệm khách hàng. Mọi ý kiến đóng góp xin vui lòng liên hệ tổng đài chăm sóc: 1900 0000 hoặc email: hotro@truongchuvananhue.edu.vn