Nội dung bài viết
Bạn có biết rằng trong không khí chúng ta hít thở, nitơ chiếm nhiều nhất? Nó chiếm 78%, còn lại 21% oxy và 1% các loại khí khác. Mặc dù con người không sử dụng khí nitơ để thở nhưng nó rất hữu ích trong nhiều ngành công nghiệp. Vậy nitơ là gì? Nó có những tính chất đặc biệt nào và nó có những ứng dụng gì? Hãy cùng chúng tôi tìm hiểu qua bài viết dưới đây nhé!
1. Định nghĩa khí nitơ là gì?
Nitơ (N) là nguyên tố hóa học thuộc nhóm phi kim trong bảng tuần hoàn các nguyên tố. Nitơ có mặt trong mọi sinh vật sống, nó tạo thành nhiều hợp chất quan trọng như axit amin, amoniac, axit nitric,… Cơ thể con người chứa khoảng 3% trọng lượng là nitơ.
Khí nitơ có công thức hóa học N2. Nó có 5 electron ở lớp ngoài cùng nên có thể nhận nhiều electron có nhiều hóa trị khác nhau như II, III, IV.
Nitơ thường ở dạng lỏng hoặc khí (mặc dù nitơ có thể đạt được trạng thái rắn khi đông lạnh ở -210 độ C). Trong không khí, nó tồn tại dưới dạng phân tử N2, không phản ứng với các khí khác nên gọi là khí trơ. Nó hóa lỏng ở nhiệt độ rất thấp – 196 độ C, trong điều kiện áp suất khí quyển.
Với cấu trúc hóa học của nitơ, các nguyên tử nitơ cần nhiều năng lượng hơn để phân tách để phản ứng với các chất khác. So với khí oxy, khí nitơ ít phản ứng hơn, không bắt lửa và thực hiện các phản ứng đốt cháy. Đây cũng là lý do ngăn chặn quá trình oxy hóa chậm và nhanh, giúp con người được an toàn trong điều kiện nhiệt độ và áp suất bình thường.

Cấu trúc khí nitơ
2. Cấu trúc phân tử của nitơ
Phân tử nitơ gồm 2 nguyên tử, tạo thành liên kết ba giữa chúng vì nó có 5 electron ở lớp ngoài cùng nên thể hiện hóa trị ba trong hầu hết các hợp chất.
Trong các hợp chất, nitơ thể hiện nhiều mức oxi hóa khác nhau. Trong số đó, mức oxy hóa cao nhất là +5, trong khi mức -3 và +3 ít phổ biến hơn. Riêng N còn có thêm mức oxi hóa +1, +2 và +4.
3. Tính chất của khí nitơ
Khí nitơ có những đặc điểm sau:
3.1. Tính chất vật lý
Khí nitơ là chất khí không màu, không mùi, không vị. Nó có khối lượng nhỏ hơn không khí. Nitơ chiếm 4/5 không khí nhưng không có khả năng duy trì quá trình đốt cháy và sự sống.
Nitơ ít tan trong nước. Các thông số điển hình bao gồm:
- Nhiệt độ hóa lỏng ở -196 độ C: Khí ngưng tụ thành chất lỏng không màu, nhẹ hơn nước.
- Nhiệt độ hóa rắn cũng rất thấp ở mức -210 độ C
3.2. Tính chất hóa học
Nitơ là hoạt chất ít khi tham gia phản ứng hóa học, chỉ trong những điều kiện nhất định vì phân tử chứa liên kết ba rất ổn định nên trong điều kiện bình thường. Nitơ vừa là chất khử, vừa là chất oxi hóa.
Mức độ oxy hóa mà nitơ có thể có là: -3, 0, +1, +2, +3, +4, +5. Nó có số oxi hóa bằng 0 nên vừa có tính oxi hóa vừa có tính khử.
– Tính chất oxy hóa
- Nitơ phản ứng với kim loại: Nitơ thể hiện tính chất oxy hóa khi phản ứng với các nguyên tố có độ âm điện nhỏ hơn.
Trong điều kiện nhiệt độ bình thường, nitơ chỉ phản ứng với lithium tạo thành lithium nitride: 6 Li + N2 → 2 Li3N
Ở điều kiện nhiệt độ cao, nitơ phản ứng với nhiều kim loại như 3 Mg + N2 → Mg3N2
Tuy nhiên, nitrit dễ bị phân hủy tạo thành NH3
- Nitơ phản ứng với H2: Ở nhiệt độ cao, áp suất cao và có chất xúc tác. Nitơ phản ứng với hydro để tạo ra amoniac.
– Tính khử (N2 + O2): Nitơ thể hiện tính khử khi phản ứng với các nguyên tố có độ âm điện lớn hơn như oxy.
Phản ứng của nitơ với oxy xảy ra ở nhiệt độ 3000 độ C hoặc trong lò hồ quang điện: 2N + O2 → 2NO
Sau đó, nitơ monoxit phản ứng với oxy trong khí quyển tạo ra nitơ dioxit màu nâu đỏ: NO+1/2O2→NO2
Các oxit nitơ khác là N2O, N2O3, N2O5 không thể điều chế trực tiếp từ phản ứng giữa oxy và nitơ.
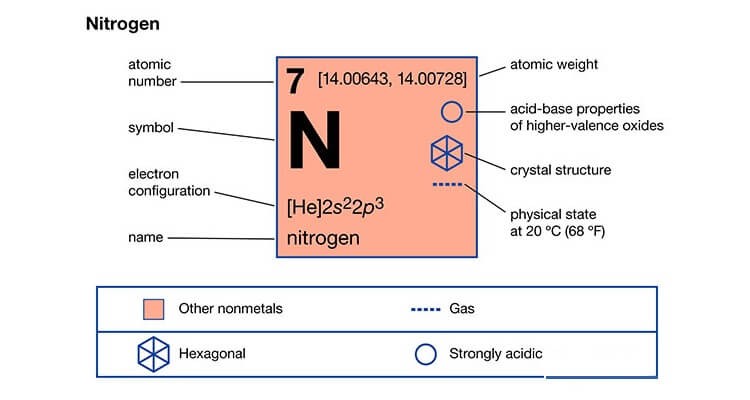
Một số tính chất của khí nitơ
4. Ứng dụng của nitơ trong cuộc sống
Nitơ được sử dụng rộng rãi, chủ yếu là do tính chất không phản ứng của nó khi tiếp xúc với các loại khí khác. Vì vậy, nó được sử dụng làm khí bao phủ. Lớp phủ nitơ được sử dụng để bảo vệ chất rắn và chất lỏng dễ cháy hoặc nổ khi tiếp xúc với không khí.
- Trong công nghiệp, phần lớn nitơ được sử dụng để tổng hợp khí amoniac, sau đó là sản xuất axit nitric, phân đạm, v.v. Nhiều ngành công nghiệp như luyện kim, thực phẩm, điện tử, v.v. sử dụng nitơ làm môi trường. trơ.
- Trong y học và dược phẩm, nitơ lỏng được sử dụng để bảo quản máu và các mẫu sinh học khác. Ngoài ra, đây còn là môi trường làm lạnh sâu, nhanh chóng các sản phẩm huyết thanh, vi khuẩn… Nitơ lỏng được sử dụng trong phẫu thuật lạnh để tiêu diệt mô bệnh.
- Trong ngành thực phẩm và đồ uống, nitơ được sử dụng để thay thế oxy trong việc bảo quản nông sản và đồ uống tốt hơn. Do nitơ lỏng cực lạnh nên thực phẩm có thể được đông lạnh rất nhanh.
- Ngành công nghiệp dầu khí, nhà máy lọc dầu, nhà máy hóa dầu và tàu chở dầu biển sử dụng nitơ để làm sạch thiết bị, bể chứa và đường ống chứa hơi và khí nguy hiểm. Ngoài ra, nó làm mát các lò phản ứng chứa đầy chất xúc tác trong quá trình bảo trì.
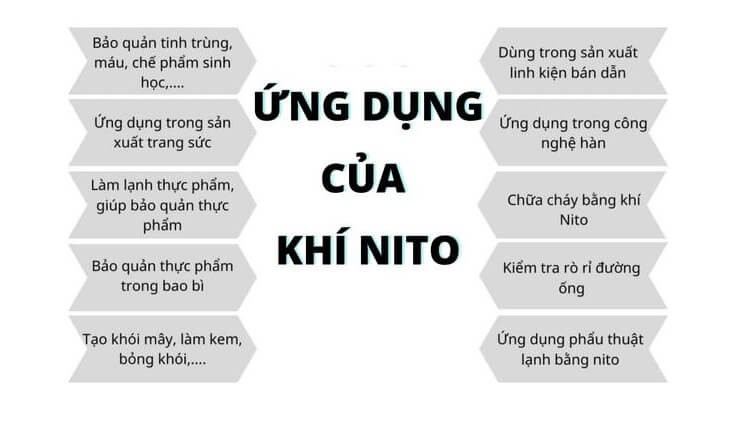
Ứng dụng khí nitơ
Trên đây là những kiến thức về nitơ cũng như khí nitơ trong không khí. Điều này sẽ giúp bạn hiểu rõ hơn về một loại khí phổ biến xung quanh chúng ta.


Nội dung được phát triển bởi đội ngũ truongchuvananhue.edu.vn với mục đích chia sẻ và tăng trải nghiệm khách hàng. Mọi ý kiến đóng góp xin vui lòng liên hệ tổng đài chăm sóc: 1900 0000 hoặc email: hotro@truongchuvananhue.edu.vn