Nội dung bài viết
Tỷ trọng hơi là gì và công thức tính đang được nhiều người nghiên cứu. Nếu bạn quan tâm đến nội dung này hãy cùng Trường Chu Văn An khám phá thông tin chi tiết trong bài viết dưới đây nhé.
1. Mật độ hơi là gì?
Mật độ hơi thường được sử dụng trong nội dung liên quan đến khí. Theo đó, dựa vào công thức tính mật độ hơi sẽ xác định được chất A nặng hơn hoặc nhẹ hơn chất B bao nhiêu lần. Vậy mật độ hơi chính là công thức xác định khối lượng phân tử của chất A so với chất B.
Mật độ hơi là công thức xác định khối lượng phân tử giữa hai chất khí
2. Ý nghĩa của mật độ hơi
Như đã phân tích ở trên, mật độ hơi cho biết khối lượng phân tử của chất A và chất B. Trong vật lý và hóa học, mật độ này rất quan trọng để so sánh khối lượng của các chất khí. Việc hiểu và biết cách áp dụng mật độ sẽ giúp ích cho quá trình nghiên cứu cũng như ứng dụng vào thực tế.
Ngày nay, các nhà khoa học có thể dựa vào mật độ hơi của khí để kiểm soát sự an toàn và chất lượng của một chất. Đồng thời, đây cũng là một trong những yếu tố góp phần nâng cao hiểu biết về tính chất của các chất khí. Vì vậy, chúng có ý nghĩa rất lớn đối với ngành công nghiệp và lĩnh vực khoa học.

Hiểu mật độ hơi giúp kiểm soát sự an toàn và chất lượng của một chất
3. Cách tính mật độ hơi
Mật độ hơi có công thức sau:
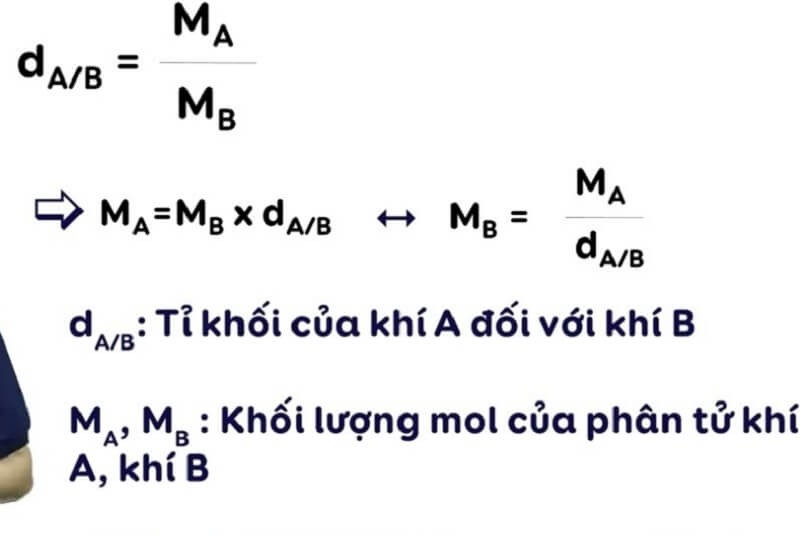
dA/B=MA/MB
Trong đó:
- MA là khối lượng mol của khí A.
- MB là khối lượng mol của khí B.
- dA/B là mật độ của khí A so với khí B.
Ngoài ra, còn có một số công thức tính mật độ hơi riêng cho từng loại khí như sau:
3.1. Tỉ số thể tích hơi của khí A so với khí B
Mật độ hơi có ý nghĩa trong việc đánh giá khí A nặng hơn hay nhẹ hơn khí B. Dựa vào đó có thể áp dụng công thức sau:
Khí A nặng hơn hoặc nhẹ hơn khí B bao nhiêu lần tính theo khối lượng mol của nó. Công thức tính toán như sau:
dA/B=MA/MB
Để xác định khí B nặng hơn hoặc nhẹ hơn khí A bao nhiêu lần, áp dụng công thức:
DB/A=MB/MA
Công thức tính mật độ hơi của khí A so với khí B
3.2. Tỷ lệ khối lượng của hơi so với oxy
Theo cấu trúc phân tử, khối lượng mol của khí oxy là 32. Khi đó, tỷ lệ khối lượng của hơi và oxy sẽ được tính như sau:
dA/O2 = MA / MO2 = MA / 32
Ví dụ: Tính mật độ của carbon dioxide và oxy
Giải: Áp dụng công thức trên ta có: dCo2/O2 = MCo2 / MO2 = 44/32 = 1,375
Kết luận: Carbon dioxide nặng hơn oxy và nặng hơn 1.375 lần.
3.3. Tỷ lệ hơi của oxy và nitơ
Áp dụng công thức trên, mật độ hơi của oxy và nitơ trở thành:
dO2/N2 = MO2 / MN2 = 32/28 = 1,14
3.4. Tỷ lệ khối lượng của hơi và heli
Công thức tính mật độ hơi của bất kỳ loại khí nào so với helium được áp dụng tương tự như trên. Cụ thể:
DA/Anh ấy = MA / MHe = MA / 4
3.5. Tỷ lệ khối lượng của hơi so với không khí
Để đánh giá khí A nhẹ hơn hay nặng hơn không khí người ta dựa vào khối lượng mol giống như các khí trên. Không khí bao gồm nhiều thành phần nhưng chủ yếu là khí nitơ và khí oxy với tỷ lệ 80:20.
Khi đó không khí có khối lượng mol là:
Mkk = (0,8 x 28) + (0,2 x 32) = 29 (g/mol)
Vậy mật độ hơi của bất kỳ khí nào (khí A) so với không khí như sau:
dA/kk = MA / Mkk = MA / 29
Ví dụ: So sánh phần khối lượng hơi của h2 với không khí
Giải pháp: Tỷ lệ khối lượng của hơi và hydro và không khí như sau:
DH2/kk = MH2 / Mkk = 2/29 = 0,07
Vậy khí hydro chỉ nặng hơn không khí 0,07 lần.
4. Các dạng bài tập về mật độ hơi
Thông qua định nghĩa về mật độ hơi có thể áp dụng để tính toán và giải các bài tập liên quan. Bao gồm:
Bài tập 1: Tính khối lượng mol
Hỗn hợp khí A chứa nhiều khí có khối lượng phân tử khác nhau. Cụ thể:
- Khí A1 có a1 mol
- Khí A2 có a2 mol
- Khí A3 có a3 mol…
- Một chất khí có một nốt ruồi
Công thức tính toán được áp dụng như sau:
MA = (a1M1 + a2M2… anMn) / (a1 + a2 + … + an)
Khi đó: dA/B = MA/MB
Bài tập 2: Tính mật độ hơi của một chất khí
Dạng cơ bản: Tính mật độ dựa trên các công thức đã cho.
Dạng nâng cao: Tính khối lượng riêng của hỗn hợp khí này với không khí hoặc hỗn hợp khí khác.
Bài 3: Bài tập tóm tắt
Ví dụ: Cho hỗn hợp A gồm 0,05 mol CO2 và 0,1 mol SO3.
A, Tính khối lượng mol trung bình của các chất trong hỗn hợp
B, Tính mật độ hơi của hỗn hợp A so với khí O2
Giải pháp
A, Để tính khối lượng mol trung bình của hỗn hợp A, ta làm như sau:
Trung bình hỗn hợp M = (nCo2.MCo2 + nSO3.MSO3) / (nCo2 + nSO3)
= (0,05,44 + 0,1,80) / (0,05 + 0,1) = (2,2 + 8) / 0,15
= 68 (gam/mol)
B, dA/O2 = Trung bình hỗn hợp M / MO2 = 68/32 = 2,125
Vậy khối lượng riêng của hỗn hợp X và O2 là 2,125
Bài viết trên đã phân tích chi tiết về mật độ xông hơi và các bài tập cơ bản. Nếu muốn tìm hiểu thêm về tỷ lệ khối này, bạn có thể liên hệ với Trường Chu Văn An theo số hottline của chúng tôi để được hỗ trợ.


Nội dung được phát triển bởi đội ngũ truongchuvananhue.edu.vn với mục đích chia sẻ và tăng trải nghiệm khách hàng. Mọi ý kiến đóng góp xin vui lòng liên hệ tổng đài chăm sóc: 1900 0000 hoặc email: hotro@truongchuvananhue.edu.vn