Nội dung bài viết
H2O2 còn được biết đến với cái tên quen thuộc hơn là hydrogen peroxide. Vì nó có đặc tính oxy hóa mạnh nên nó được sử dụng rộng rãi trong nhiều ngành công nghiệp khác nhau, trong đó có y học. Tuy nhiên, chúng cũng có thể nguy hiểm nếu sử dụng không đúng cách. Vậy có lưu ý gì khi sử dụng H2O2 trong y học? Hãy cùng nhau tìm hiểu qua bài viết dưới đây.
1. H2O2 là gì? Công thức phân tử?
H2O2 (hydro peroxide) là chất lỏng trong suốt, hơi nhớt hơn nước. Công thức phân tử của H2O2 như sau:
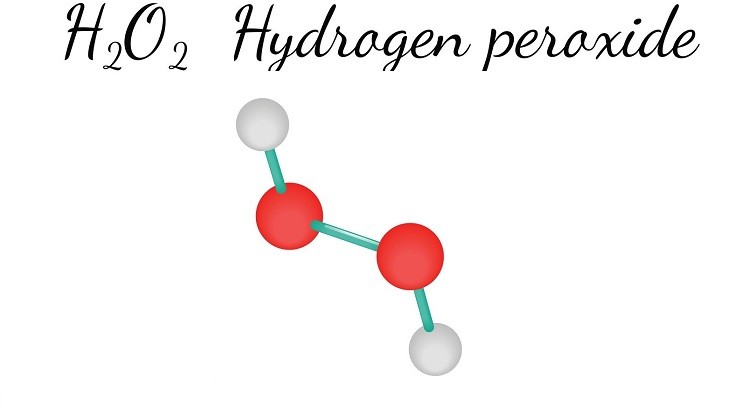
Công thức cấu tạo của H2O2
Hydrogen peroxide có thể có nồng độ khác nhau tùy thuộc vào mục đích sử dụng. Một số nồng độ phổ biến bao gồm:
- Khoảng 3%: nồng độ điển hình cho các sản phẩm làm sạch bề mặt, chất khử trùng, v.v.
- 6–10%: nồng độ trong một số sản phẩm nhuộm tóc và làm trắng răng.
- 35%: tập trung trong công nghiệp thực phẩm để chế biến, tẩy trắng một số loại thực phẩm.
- 90%: nồng độ dùng trong sản phẩm công nghiệp, không dùng trong gia đình.
2. Tính chất lý hóa của H2O2
2.1. Tính chất vật lý
– H2O2 và các nguyên tử của nó không nằm trên cùng một mặt phẳng do lực đẩy của cặp electron của hai nguyên tử Oxy.
– Ở điều kiện bình thường nó ở dạng lỏng, không màu, có mùi hơi hăng.
2.2. Tính chất hóa học
– Phản ứng phân hủy:
Hydrogen peroxide trong điều kiện bình thường bị phân hủy bởi phản ứng tỏa nhiệt tạo thành nước và khí oxy:
2H2O2 → 2H2O + O2 + Nhiệt
– Phản ứng oxi hóa khử:
Trong dung dịch nước, H2O2 phản ứng oxy hóa hoặc khử nhiều loại ion vô cơ. Khi nó là chất khử, khí oxy được tạo ra. Trong dung dịch axit, ion sắt(II) Fe2+ bị oxy hóa thành ion sắt Fe3+ theo phản ứng sau:
2Fe2+ (dung dịch) + H2O2 + 2H+ (dung dịch) → 2Fe3+ (dung dịch) + 2H2O (lỏng)
– Tính axit với phản ứng tạo peroxit: Thể hiện tính axit nhờ gốc -OH, có khả năng phản ứng với các bazơ mạnh tạo thành muối hydrogen peroxide hoặc peroxit hoặc dẫn xuất của nhiều kim loại.
Na2B4O7 + 4H2O2 + 2NaOH → 2Na2B2O4(OH)4 + H2O
– Tính chất bazơ: H2O2 rất bazơ nên chỉ phản ứng với các axit rất mạnh như HF/SbF5 tạo thành hợp chất không ổn định chứa ion (H3O2)+
3. Ứng dụng H2O2 trong lĩnh vực y tế
Trong lĩnh vực y tế, hydrogen peroxide được sử dụng với nhiều vai trò khác nhau:
- Sát trùng nhẹ: Nó được sử dụng để làm sạch da và khử trùng vết thương hoặc tổn thương bề ngoài của da. Vì đặc tính sủi bọt của chúng khi tiếp xúc với máu cho phép thực hiện hoạt động làm sạch cơ học bằng cách giải phóng oxy nên chúng tạm thời làm giảm số lượng vi sinh vật. Từ đó, trong y học nó được sử dụng ngoài da để giúp làm sạch vết thương và ngăn ngừa nhiễm trùng hiệu quả.
- Cầm máu: Bôi hydrogen peroxide lên da giúp cầm máu ở những vết thương nhỏ.
- Ngoài ra, còn dùng để súc miệng loại bỏ chất nhầy hoặc giảm kích ứng nhẹ ở miệng trong các trường hợp loét miệng/herpes, viêm nướu…
Trong bệnh viện, hydrogen peroxide có khả năng phản ứng với lưu huỳnh giúp giảm mùi hôi trong hệ thống ống xả.
Ứng dụng H2O2 trong lĩnh vực y tế
4. Những lưu ý khi sử dụng H2O2 an toàn trong y học
H2O2 có rất nhiều công dụng nhưng vẫn có một số lo ngại về an toàn nếu sử dụng không đúng cách. Dưới đây là một số lưu ý khi sử dụng oxy già trong y học:
4.1. Cách sử dụng
– Không nên sử dụng sản phẩm này để điều trị vết thương sâu, vết cắn của động vật hoặc vết bỏng nặng. Ngày nay, do đặc tính oxy hóa mạnh nên nó không còn được sử dụng phổ biến trong sơ cứu nữa.
– Khi vết thương còn trên da non không nên sử dụng hydrogen peroxide vì nó làm tổn thương mô và làm chậm quá trình lành vết thương.
– Tuyệt đối không dùng dung dịch H2O2 đậm đặc để sát trùng vết thương.
– Nhiều người sử dụng hydrogen peroxide để điều trị mụn trứng cá do tính chất sát trùng của nó tương tự như benzoyl peroxide. Nhưng hydrogen peroxide và benzoyl peroxide không giống nhau. Vì vậy không nên sử dụng nó để trị mụn.
– Chất khử trùng này không thích hợp để khử trùng kéo, dao cạo râu và các vật dụng có khả năng bị ô nhiễm khác.
4.2. Cách bảo quản
– Bảo quản đúng cách: Nếu trẻ em hoặc người lớn vô tình nuốt phải có thể gây nôn mửa, kích ứng đường tiêu hóa, bỏng, phồng rộp da…
Vì vậy, cần phải bảo quản cẩn thận và dán nhãn cảnh báo đầy đủ.
– Hydrogen peroxide dễ phân hủy khi có ánh sáng nên bảo quản tránh ánh nắng trực tiếp.
– Hơi hydrogen peroxide dễ cháy nổ ở nhiệt độ 70 độ nên để xa các dung dịch và thiết bị dễ cháy. Và không bảo quản ở nhiệt độ cao, bảo quản trong hộp nhựa đặc biệt, không đựng trong lọ thủy tinh hoặc kim loại.
Trên đây là một số lưu ý khi sử dụng H2O2 trong y học. Với nhiều công dụng tiềm năng chúng ta có thể sử dụng một cách hiệu quả và an toàn.


Nội dung được phát triển bởi đội ngũ truongchuvananhue.edu.vn với mục đích chia sẻ và tăng trải nghiệm khách hàng. Mọi ý kiến đóng góp xin vui lòng liên hệ tổng đài chăm sóc: 1900 0000 hoặc email: hotro@truongchuvananhue.edu.vn