Các dạng toán khử oxit kim loại bằng C, H2, CO, kim loại mạnh và cách giải – Trọn bộ các dạng bài tập Hóa học lớp 12 với phương pháp giải chi tiết giúp bạn biết cách làm bài tập Hóa 12.-Các dạng toán khử oxit kim loại bằng C, H2, CO, kim loại mạnh và cách giải
Các dạng toán khử oxit kim loại bằng C, H2, CO, kim loại mạnh và cách giải
Với Các dạng toán khử oxit kim loại bằng C, H2, CO, kim loại mạnh và cách giải sẽ giúp học sinh nắm vững lý thuyết, biết cách làm bài tập
từ đó có kế hoạch ôn tập hiệu quả để đạt kết quả cao trong các bài thi môn Hóa 12.
Các dạng toán khử oxit kim loại bằng C, H2, CO, kim loại mạnh và cách giải

A. Lý thuyết ngắn gọn
Chất khử C, H2, CO, kim loại mạnh có thể khử kim loại trong oxit ở nhiệt độ cao.
Ví dụ :
Fe2O3 + 3CO 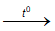 2Fe + 3CO2
2Fe + 3CO2
Cr2O3 + 2Al 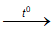 Al2O3 + 2Cr
Al2O3 + 2Cr
Chú ý: chất khử chỉ khử được oxit của kim loại sau Al.
Phương pháp này được sử dụng để sản xuất kim loại trong công nghiệp. Chất khử hay được sử dụng trong công nghiệp là C.
B. Phương pháp giải
Viết phương trình hóa học và tính theo phương trình hóa học
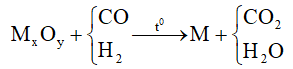
Chú ý: M là các kim loại sau Al trong dãy điện hóa.
+ Công thức tính nhanh 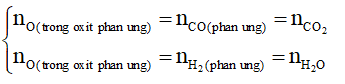
Nếu hỗn hợp hai khí: 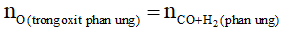
+ Bảo toàn khối lượng: 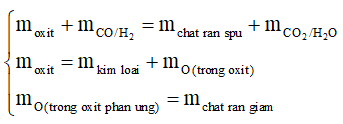
C. Ví dụ minh họa
Ví dụ 1: Cho luồng khí CO (dư) đi qua 4,8 gam hỗn hợp X gồm CuO và Fe2O3 (tỉ lệ mol là 1:1) nung nóng đến khi phản ứng hoàn toàn, thu được m gam chất rắn. Giá trị của m là
A. 3,52.
B. 4,48.
C. 2,40.
D. 4,16.
Lời giải chi tiết
Gọi số mol của CuO và Fe2O3 là a mol
Ta có: 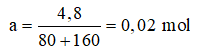
Phương trình hóa học:
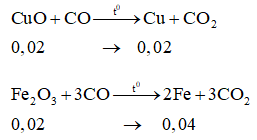
→ mchất rắn = mCu + mFe = 0,02.64 + 0,04.56 = 3,52 gam
Chọn A.
Ví dụ 2: Khử hoàn toàn a gam oxit Fe3O4 cần dùng 2,24 lít khí H2 (đktc). Giá trị của a là
A. 5,8.
B. 23,2.
C. 11,6.
D. 17,4.
Lời giải chi tiết
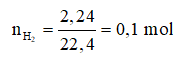
Phương trình hóa học:
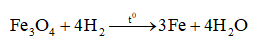
Theo phương trình: 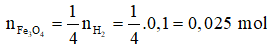
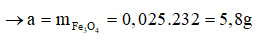
Chọn A.
Ví dụ 3: Để khử hoàn toàn 19,36 gam hỗn hợp CuO, FeO, Fe2O3, Fe3O4 cần dùng 7,392 lít khí CO (ở đktc). Khối lượng chất rắn sau phản ứng là
A. 14,8 gam.
B. 15,08 gam.
C. 10,05 gam.
D. 10,45 gam.
Lời giải chi tiết
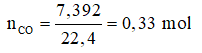
Ta có: nO trong oxit phản ứng = nCO phản ứng = 0,33 mol
→ mchất rắn giảm = mO trong oxit phản ứng = 0,33.16 = 5,28 gam
Khối lượng chất rắn sau phản ứng là:
mchất rắn sau phản ứng = mchất rắn ban đầu – mchất rắn giảm = 19,36 – 5,28 = 14,08 gam
Chọn A.
D. Bài tập tự luyện
Câu 1: Khử 16 gam Fe2O3 bằng CO dư, sản phẩm khi cho vào bình đựng nước vôi trong dư thu được a gam kết tủa. Biết các phản ứng xảy ra hoàn toàn. Giá trị của a là
A. 30.
B. 20.
C. 10.
D. 40.
Câu 2: Trong bình kín có chứa 0,5 mol CO và m gam Fe3O4. Đun nóng bình cho tới khi phản ứng xảy ra hoàn toàn, thu được hỗn hợp khí có tỉ khối so với CO ban đầu là 1,457. Giá trị của m là
A. 16,8.
B. 21,5.
C. 22,8.
D. 23,2.
Câu 3: Để khử hoàn toàn 19,6 gam hỗn hợp X gồm Fe, FeO, Fe2O3 cần dùng vừa đủ 2,24 lít H2 (đktc). Khối lượng Fe thu được là
A. 15 gam
B. 16 gam
C. 17 gam
D. 18 gam
Câu 4: Cho V lít khí CO (ở đktc) phản ứng với một lượng dư hỗn hợp chất rắn gồm CuO và Fe3O4 nung nóng. Sau khi phản ứng hoàn toàn, khối lượng hỗn hợp chất rắn giảm 0,32 gam. Giá trị của V là
A. 0,112
B. 0,224
C. 0,448
D. 0,560
Câu 5: Cho luồng khí CO (dư) đi qua 9,1 gam hỗn hợp gồm CuO và Al2O3 nung nóng đến khi phản ứng hoàn toàn, thu được 8,3 gam chất rắn. Khối lượng CuO có trong hỗn hợp ban đầu là
A. 4,0 gam
B. 8,3 gam
C. 2,0 gam
D. 0,8 gam
Câu 6: Cho khí CO qua ống chứa 15,2 gam hỗn hợp gồm CuO và FeO nung nóng. Sau một thời gian thu được hỗn hợp khí B và 13,6 gam chất rắn C. Cho B tác dụng với dung dịch Ca(OH)2 dư thu được m gam kết tủa. Giá trị của m là
A. 15
B. 10
C. 20
D. 25
Câu 7: Dẫn luồng khí CO dư đi qua 2,4 gam hỗn hợp CuO và Fe2O3 nung nóng đến phản ứng xảy ra hoàn toàn, thu được 1,76 gam chất rắn. Phần trăm khối lượng CuO có trong hỗn hợp ban đầu là
A. 47,06%
B. 26,67%
C. 66,67%
D. 33,33%
Câu 8: Cho V lít (đktc) khí H2 đi qua bột CuO đun nóng, thu được 38,4 gam Cu. Nếu cho V lít khí H2 đi qua bột Fe2O3 đun nóng thì lượng Fe thu được là
A. 25,2 gam
B. 26,4 gam
C. 22,4 gam
D. 33,6 gam
Câu 9: Cho 4,48 lít khí CO (đktc) phản ứng với 8 gam một oxit kim loại, sau khi phản ứng hoàn toàn, thu được m gam kim loại và hỗn hợp khí có tỉ khối so với H2 là 20. Giá trị của m là
A. 7,2
B. 3,2
C. 6,4
D. 5,6
Câu 10: Cho m gam hỗn hợp X gồm CuO, Fe2O3, FeO tác dụng vừa đủ với 100 ml dung dịch chứa H2SO4 1M và HCl 1M. Để khử hoàn toàn m gam hỗn hợp X (nung nóng) cần tối thiểu V lít khí CO (đktc). Giá trị của V là
A. 4,48
B. 6,72
C. 3,36
D. 1,12
ĐÁP ÁN
|
Câu 1 |
Câu 2 |
Câu 3 |
Câu 4 |
Câu 5 |
Câu 6 |
Câu 7 |
Câu 8 |
Câu 9 |
Câu 10 |
|
A |
D |
D |
C |
A |
B |
D |
C |
D |
C |
Xem thêm các phương pháp giải nhanh bài tập Hóa học hay khác:



Nội dung được phát triển bởi đội ngũ truongchuvananhue.edu.vn với mục đích chia sẻ và tăng trải nghiệm khách hàng. Mọi ý kiến đóng góp xin vui lòng liên hệ tổng đài chăm sóc: 1900 0000 hoặc email: hotro@truongchuvananhue.edu.vn