Nội dung bài viết
Polyphosphate (còn gọi là polyphosphate) là một hợp chất hóa học quan trọng, được tạo thành từ các chuỗi ion photphat liên kết với nhau bằng liên kết phốt pho-oxy. Với những đặc tính đa năng và ứng dụng rộng rãi trong công nghiệp, nông nghiệp, y học và bảo vệ môi trường, polyphosphate đóng vai trò không thể thiếu trong nhiều lĩnh vực hiện đại. Hãy cùng tìm hiểu chi tiết về hợp chất này, từ cấu trúc, tính chất cho đến những ứng dụng nổi bật của nó.
1. Định nghĩa Polyphosphate
Polyphosphate (còn gọi là polyphosphate) là một nhóm các hợp chất hóa học được tạo thành từ các phân tử phốt phát liên kết với nhau thông qua liên kết phospho-oxy-phospho (POP). Đây là polyme của các anion photphat (PO₄³⁻), được hình thành do sự ngưng tụ của các đơn vị photphat đơn. Công thức chung của polyphosphate thường được viết là [(PO₄)ₓ]ⁿ⁻, trong đó “x” đại diện cho số nhóm phốt phát trong chuỗi.
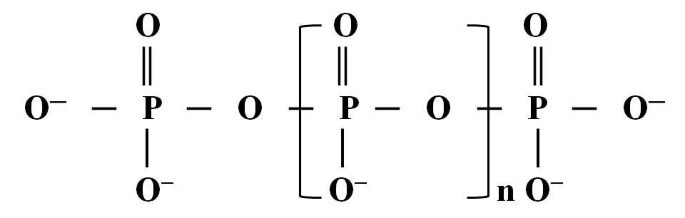
2. Các loại Polyphosphate
Polyphosphate có thể tồn tại ở nhiều dạng khác nhau tùy thuộc vào độ dài chuỗi, cấu trúc và cách sử dụng, bao gồm:
Pyrophosphate: Loại polyphosphate đơn giản nhất có hai nhóm photphat liên kết với nhau.
Tripolyphosphate: Có ba nhóm phốt phát trong cấu trúc.
Polyphosphate chuỗi dài: Bao gồm hàng trăm hoặc thậm chí hàng nghìn nhóm phốt phát liên kết thành chuỗi dài.
3. Tính chất lý hóa của Polyphosphate
Tính chất vật lý
- Trạng thái: Có thể tồn tại ở dạng rắn (bột, hạt) hoặc dạng lỏng (dung dịch).
- Độ hòa tan: Phụ thuộc vào độ dài chuỗi; Polyphosphate ngắn hòa tan trong nước hơn polyphosphate dài.
Tính chất hóa học
- Tính ổn định: Polyphosphate ổn định trong điều kiện trung tính và kiềm, nhưng có thể bị thủy phân trong môi trường axit để giải phóng phốt phát đơn.
- Tính chất chelat: Có khả năng liên kết với các ion kim loại, làm giảm độ cứng của nước.
4. Nguồn gốc và quá trình tổng hợp
Nguồn tự nhiên
Polyphosphate xảy ra trong các sinh vật sống, đặc biệt là ở vi khuẩn và tế bào thực vật. Trong cơ thể, polyphosphate được dự trữ và sử dụng làm nguồn năng lượng dự trữ hoặc tham gia vào quá trình trao đổi chất.
Sản xuất công nghiệp
Polyphosphate được sản xuất chủ yếu thông qua phản ứng tổng hợp hoặc phản ứng hóa học giữa axit photphoric và các hợp chất kiềm, như:
- Phương pháp nhiệt: Làm nóng chảy axit photphoric ở nhiệt độ cao.
- Phương pháp hóa học: Kết hợp muối photphat trong điều kiện được kiểm soát chặt chẽ.
5. Ứng dụng của Polyphosphate
Polyphosphate đóng vai trò quan trọng trong nhiều lĩnh vực nhờ những đặc tính độc đáo của nó:
Công nghiệp thực phẩm
Polyphosphate được sử dụng làm phụ gia thực phẩm như chất ổn định, chất làm đặc và chất nhũ hóa. Cải thiện kết cấu của thịt, cá và các sản phẩm từ sữa bằng cách giữ nước và tăng độ mềm. Ngăn chặn sự kết tinh của muối khoáng trong thực phẩm đông lạnh.
Xử lý nước
Polyphosphate giúp kiểm soát sự hình thành cặn (như canxi và magiê) trong hệ thống xử lý nước. Được sử dụng trong chất tẩy rửa để làm mềm nước cứng.
Hóa chất công nghiệp
Hoạt động như một tác nhân chelat trong nhiều quá trình hóa học. Dùng trong sản xuất phân bón, chất tẩy rửa công nghiệp và phụ gia bê tông.
Sinh học và y học
Polyphosphate là thành phần tự nhiên trong cơ thể, tham gia vào quá trình trao đổi chất và bảo vệ tế bào. Nghiên cứu trong lĩnh vực y học ứng dụng trong điều trị bệnh và kiểm soát vi khuẩn.
6. Lợi ích và rủi ro khi sử dụng Polyphosphate
Lợi ích:
Tăng hiệu quả sản xuất và nâng cao chất lượng sản phẩm trong nhiều ngành công nghiệp. Giảm thiểu chi phí xử lý nước nhờ khả năng ngăn chặn cặn.
Rủi ro:
Dư lượng polyphosphate trong thực phẩm hoặc nước uống nếu vượt quá có thể ảnh hưởng đến sức khỏe con người, gây rối loạn chức năng thận hoặc tích tụ phosphate trong cơ thể. Việc sản xuất và sử dụng polyphosphate đòi hỏi phải tuân thủ nghiêm ngặt các quy định an toàn hóa chất để tránh ô nhiễm môi trường. Polyphosphate là hợp chất hóa học đa năng có nhiều ứng dụng quan trọng trong đời sống và công nghiệp. Tuy nhiên, để đảm bảo an toàn sức khỏe và môi trường, cần sử dụng và quản lý polyphosphate phù hợp, tuân thủ các quy định về tiêu chuẩn và liều lượng.


Nội dung được phát triển bởi đội ngũ truongchuvananhue.edu.vn với mục đích chia sẻ và tăng trải nghiệm khách hàng. Mọi ý kiến đóng góp xin vui lòng liên hệ tổng đài chăm sóc: 1900 0000 hoặc email: hotro@truongchuvananhue.edu.vn