Nội dung bài viết
Trong đời sống hàng ngày, đặc biệt là trong các ngành công nghiệp sản xuất sắt thép, xử lý nước, sản xuất thực phẩm, các hợp chất hữu cơ và vô cơ,… Axit clohydric HCl được sử dụng rất phổ biến làm nguyên liệu thô hoặc chất xúc tác. Để tìm hiểu cụ thể hơn về Axit clohiđric HCl là gì? Tính chất, cách điều chế và ứng dụng của HCl trong đời sống hiện nay là gì? Hãy cùng chúng tôi theo dõi bài viết dưới đây nhé.

Axit clohydric là gì?
Axit clohiđric HCl là gì?
Axit clohydric (viết tắt là HCl) là một hợp chất vô cơ có tính axit mạnh, tồn tại ở hai dạng: lỏng (được tạo ra từ sự hòa tan khí hydro clorua trong nước) và khí.
Một số tên gọi khác: Axit clohydric, Axit clohydric, Axit Muriatic, Chloran.
Trong công nghiệp dược phẩm, hóa học, chế phẩm xây dựng, v.v. axit clohydric được sử dụng rộng rãi. Tuy nhiên, cần cẩn thận khi sử dụng vì nó có khả năng ăn mòn các mô của con người, gây tổn thương cho cơ quan hô hấp, mắt, da và ruột.
Tính chất đặc trưng của axit clohydric
1/ Tính chất vật lý của HCl
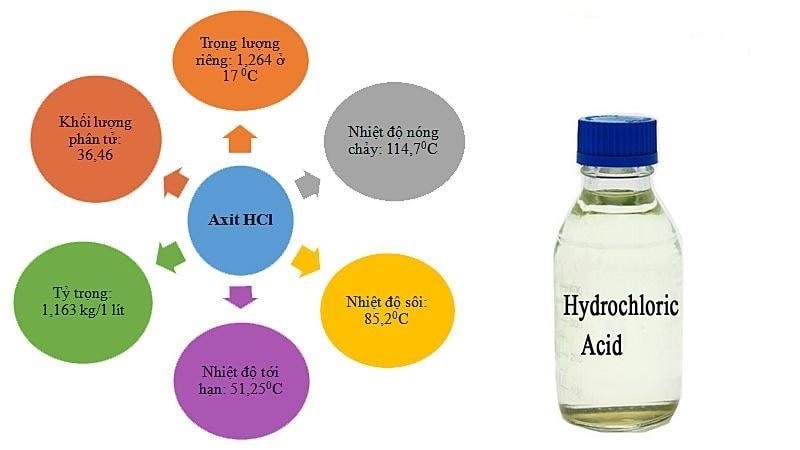
Tính chất vật lý của HCl
– Khi ở dạng khí, HCl không màu, có mùi nồng, nặng hơn không khí và tan trong nước tạo thành dung dịch axit mạnh.
– Khi ở dạng lỏng, HCl loãng không màu. Ở dạng đậm đặc 40%, axit HCl có màu xanh vàng và có thể tạo thành sương mù axit, có tính ăn mòn và có thể làm hỏng các mô của con người.
– Độ hòa tan trong nước: 725g/l ở 20 độ C.
– Trọng lượng phân tử: 36,5 g/mol.
– Dung dịch HCl dễ bay hơi.
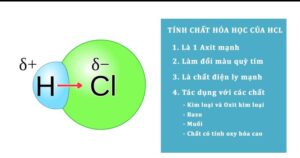
2/ Tính chất hóa học của axit clohydric – Chất phản ứng với HCl
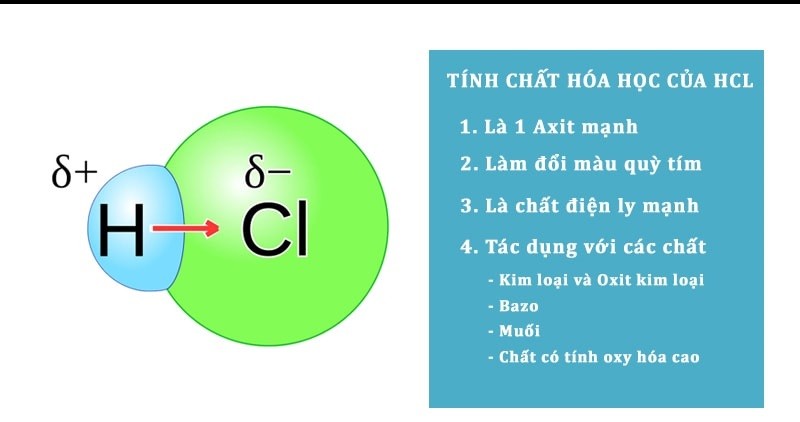
Tính chất hóa học của HCl
– Axit HCl làm đổi màu chất chỉ thị, đặc biệt là làm quỳ tím chuyển sang màu đỏ (dấu hiệu nhận biết HCl).
– HCl phản ứng với các kim loại đứng trước H trong dãy hoạt động hóa học (trừ Pb) tạo thành muối và khí hydro.
Fe + 2HCl → FeCl2 + H2↑
2Al + 6HCl → 2AlCl3 + 3H2↑
– HCl có tính oxi hóa: Phản ứng với oxit kim loại tạo thành muối clorua + nước (kim loại không thay đổi hóa trị)
CuO + 2HCl → CuCl2 + H2O
– Tác dụng bazơ tạo thành muối clorua + nước
Cu(OH)2 + 2HCl → CuCl2 + 2H2O
Al(OH)3 + 3HCl → AlCl3 + 3H2O
– HCl phản ứng với muối có gốc anion yếu hơn tạo thành muối mới và axit mới. Sản phẩm tạo thành có thể kết tủa, khí sẽ bay lên hoặc trở thành axit mới yếu hơn.
AgNO3 + HCl → AgCl + HNO3
CaCO3 + 2HCl → CaCl2 + H2O + CO2↑
– HCl có tính khử khi phản ứng với các chất oxy hóa mạnh như KMnO4, K2Cr2O7, MnO2, KClO3,… có tính khử axit clohiđric.
6HCl + KClO3 → KCl + 3Cl2↑ + 3H2O
2HCl + MnO2 → MnCl2 + Cl2↑ + H2O
14HCl + K2Cr2O7 → 2KCl + 2CrCl3 + 3Cl2↑ + 7H2O
16HCl + 2KMnO4 → 2KCl + 2MnCl2 + 5Cl2↑ + 8H2O
3/ HCl không phản ứng được với chất nào
– Các kim loại đứng sau H trong dãy điện hóa như Cu, Ag, Au,…
– Muối không tan có gốc CO3 và PO4, trừ K2CO3 và Na2CO3, K3PO4 và Na3PO4.
– HCl không phản ứng được với tất cả các axit, phi kim loại, oxit kim loại, oxit phi kim loại.
Phương pháp điều chế và sản xuất axit clohydric
1/ Trong phòng thí nghiệm
Axit clohydric được điều chế bằng phương pháp sunfat có thể đạt nồng độ lên tới 40% với phương trình điều chế diễn ra theo 2 giai đoạn:
Giai đoạn 1: NaCl rắn + H2SO4 đậm đặc → NaHSO4 + HCl (150 – 250 oC)
Giai đoạn 2: Chất rắn 2NaCl + H2SO4 đậm đặc → Na2SO4 + 2HCl (500 – 600 oC)
Sản phẩm tạo thành có độ tinh khiết cao nhưng không thể dùng để sản xuất HCl thương mại vì axit sulfuric đắt hơn axit clohydric.
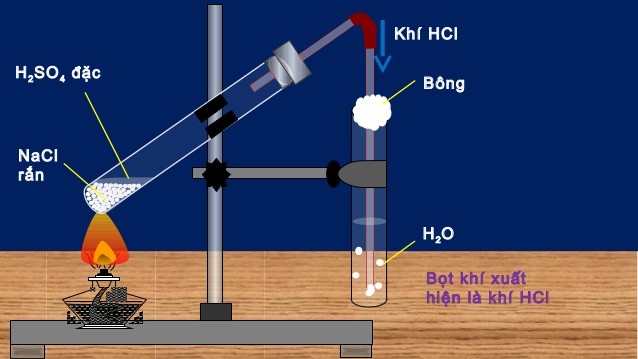
Sơ đồ điều chế HCl trong phòng thí nghiệm
2/ Trong công nghiệp
Axit clohydric điều chế trong công nghiệp thường có nồng độ từ 32 – 34% với phương trình điều chế sau:
H2 + Cl2 → 2HCl (> 2000 °C)
– HCl được tổng hợp trực tiếp từ khí clo và khí hydro nên sản phẩm có độ tinh khiết cao.
– Để đảm bảo phản ứng diễn ra hoàn toàn, lượng hydro cung cấp cao hơn clo khoảng 1 – 2%.
– Giá thành sản xuất cao vì chất phản ứng đắt tiền.
– Hỗn hợp khí hydro và khí clo có khả năng gây nổ nên cần có thiết bị đặc biệt có khả năng chịu nhiệt cao.
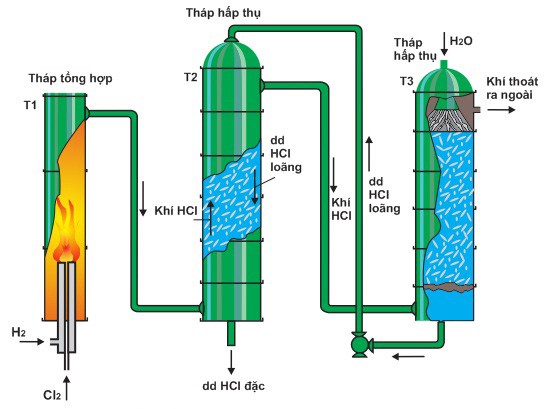
Sơ đồ điều chế HCl trong công nghiệp
Ngoài ra HCl còn được tổng hợp từ một số phương pháp khác:
– Hydrat hóa clorua kim loại nặng
2FeCl3 + 6H2O → Fe2O3 + 3H2O + 6HCl
– Nhiệt phân 1,2-diloretan thành vinyl clorua.
C2H4 + Cl2 → C2H4Cl2
C2H4Cl2 → C2H3Cl + HCl
90% HCl ở Mỹ được sản xuất bằng phương pháp này.
– Clorua của ankan RH với R là gốc hydrocarbon
Cl2 + RH → RCl + HCl
– Phản ứng trao đổi gốc clo với HF.
RCl + HF → RF + HCl
– Nhiệt phân Clodifluoromethane
2CHF2Cl → CF2=CF2 + 2HCl
– Đốt chất thải hữu cơ clo hóa
C4H6Cl2 + 5O2 → 4CO2 + 2H2O + 2HCl
Axit clohydric và ứng dụng trong đời sống
– Xử lý nước bể bơi: Cân bằng độ pH, diệt khuẩn, rêu, tảo, khử trùng,…
– Sử dụng HCl nồng độ 18% để loại bỏ rỉ sét trên thép trước khi cán, mạ điện…
Fe2O3 + Fe + 6HCl → 3FeCl2 + 3H2O

HCl giúp loại bỏ rỉ sét hiệu quả
– Sản xuất các hợp chất hữu cơ như vinyl clorua, dichlorometa, than hoạt tính, polycarbonate, axit ascorbic, một số dược phẩm,…
2CH2=CH2 + 4HCl + O2 → 2ClCH2CH2Cl + 2H2O
– Kiểm soát và trung hòa pH để điều chỉnh tính bazơ của dung dịch
OH− + HCl → H2O + Cl−
– Sản xuất các hợp chất vô cơ như hóa chất xử lý nước thải, muối clorua dùng trong mạ điện, mạ kẽm clorua trong ngành xi mạ và sản xuất pin,…
– Tham gia vào nhiều phản ứng hóa học trong dạ dày như:
+ Hòa tan các muối không tan, là chất xúc tác cho các phản ứng thủy phân đường, tinh bột và protein thành các chất đơn giản hơn mà cơ thể có thể hấp thụ được.
+ Ngăn chặn các mầm bệnh do vi khuẩn gây ra trong dạ dày, ruột.
+ Kích hoạt các chất thiết yếu trong cơ thể như hormone và enzyme tiêu hóa thức ăn.
+ Giúp cơ thể hấp thu các dưỡng chất quan trọng trong thực phẩm như vitamin A, C, E, B6, B12, canxi, magie, kẽm, sắt…
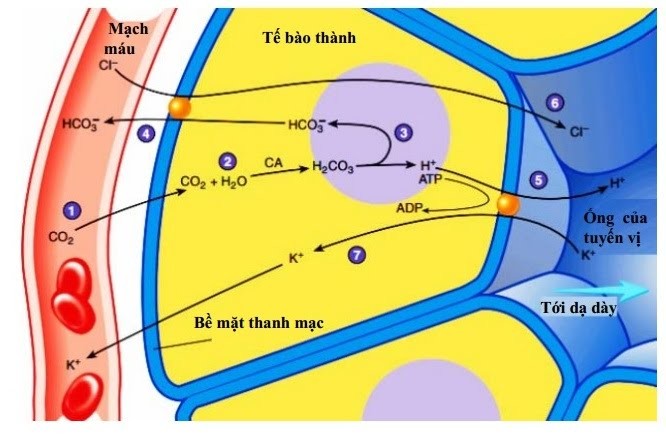
Sơ đồ sản xuất axit HCl từ tế bào thành dạ dày
– Axit clohydric được dùng trong xử lý da, lau nhà, bơm vào các lớp đá của giếng dầu để hòa tan một phần đá, tạo lỗ chân lông lớn hơn, v.v.
– Trộn HCl đậm đặc với HNO3 đậm đặc theo tỷ lệ mol 1:3 tạo thành hỗn hợp cường toan (hòa tan vàng và bạch kim).
– Sản xuất thực phẩm, phụ gia thực phẩm như aspartame, fructose, gelatin, acid citric, lysine,..
Tác hại của khí HCl tới môi trường và con người
– Tiếp xúc quá nhiều với hơi axit clohydric có thể gây ngộ độc, viêm dạ dày, viêm phế quản mãn tính, mẩn đỏ, tổn thương da hoặc bỏng nặng, giảm thị lực, v.v.
– Tiếp xúc lâu dài với khí HCl có thể gây khàn giọng, loét đường hô hấp, đau ngực, tê liệt chức năng hệ thần kinh trung ương…
– Gây bỏng, tụ máu, ứ nước ở phổi nếu nặng,…
– Làm cây chậm phát triển, giảm tính nóng của lá, làm tế bào biểu bì lá co lại,…thậm chí làm chết cây nếu tiếp xúc với nồng độ HCl cao.

Axit clohydric làm giảm độ bóng của lá
Trường Chu Văn An – Nơi cung cấp axit clohydric HCl chất lượng, giá tốt
Hiện nay, axit clohiđric HCl được phân phối rộng rãi trên thị trường. Tuy nhiên, không phải nơi nào cũng cung cấp sản phẩm đúng chất lượng, có nguồn gốc rõ ràng, thậm chí còn tăng giá sản phẩm cao hơn nhiều so với thực tế. Chính vì vậy việc lựa chọn nơi mua HCl chất lượng là điều không hề dễ dàng đối với nhiều khách hàng. Và để khách hàng có thể yên tâm mua sắm, chúng tôi xin bật mí một nhà cung cấp axit clohiđric uy tín, được đông đảo người dùng tin tưởng, trong đó có các công ty, tập đoàn lớn – đó chính là công ty Trường Chu Văn An.
Đến với Trường Chu Văn An mọi khách hàng đều được đảm bảo quyền lợi khi mua sản phẩm của công ty, trong đó có axit HCl. Tùy theo nhu cầu mà bạn có thể lựa chọn Axit HCl 30 – 35% Việt Nam hoặc Axit HCl 37% Trung Quốc.
Để được tư vấn và báo giá chi tiết hơn, vui lòng liên hệ hotline 0826 010 010 hoặc truy cập website vietchem.com.vn để các chuyên gia có thể hỗ trợ bạn tốt nhất.
Xem thêm:
- Mua axit HCl ở đâu khu vực phía Nam giá tốt nhất hiện nay
- Địa chỉ nào cung cấp HCl uy tín tại khu vực Đông Nam Bộ?
- Miền Tây Nam Bộ nên mua axit HCl ở đâu?



Nội dung được phát triển bởi đội ngũ truongchuvananhue.edu.vn với mục đích chia sẻ và tăng trải nghiệm khách hàng. Mọi ý kiến đóng góp xin vui lòng liên hệ tổng đài chăm sóc: 1900 0000 hoặc email: hotro@truongchuvananhue.edu.vn