Nội dung bài viết
Có vô số hợp chất hữu cơ được biết đến và sử dụng rộng rãi hiện nay. Đặc biệt, Ankadien là thành phần quan trọng tạo nên sản phẩm có độ đàn hồi cao. Để giúp bạn hiểu rõ hơn về chất này, Trường Chu Văn An sẽ phân tích chi tiết những thông tin liên quan đến Ankadien trong bài viết dưới đây. Hãy cùng theo dõi nhé.
1. Tìm hiểu Ankadien là gì?
Alkadienes là hydrocacbon không bão hòa có chứa hai liên kết đôi. Chúng tồn tại ở dạng mạch hở với công thức tổng quát CnH2n-2 (điều kiện: n >= 3).
Ankadien có cách đặt tên như sau: Số vị trí nhánh – tên nhánh + tên chuỗi chính + a – số vị trí đuôi. Sự kết thúc của tên sẽ có một cái tên đằng sau nó.
Ví dụ:
C3H4 (CH2 = C = CH2): Prorađien.
C4H6 (CH2 = CH – CH = CH2): Buta – 1,3 – diene.
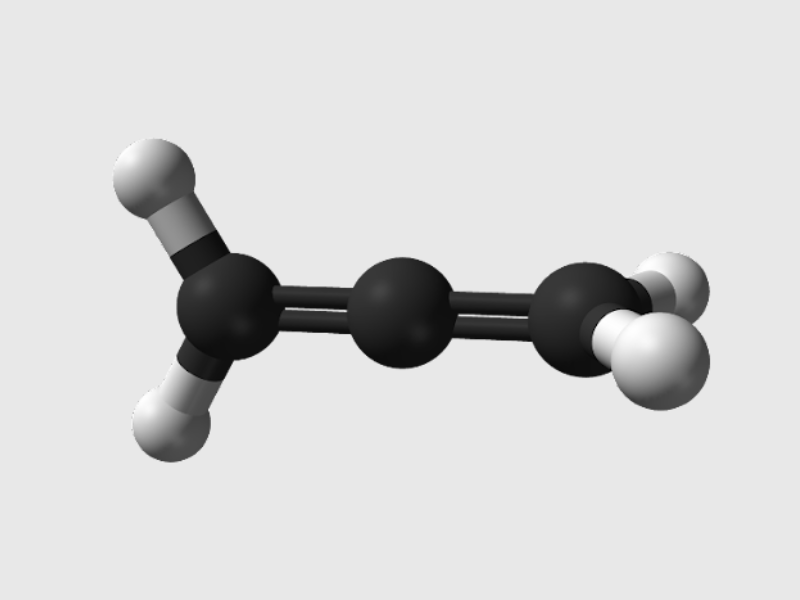
Tìm hiểu về hợp chất Alkadien
2. Tính chất hóa học của Alkadiene
Việc nắm vững Alkadiene lý thuyết, đặc biệt là tính chất hóa học của hợp chất này sẽ giúp ích rất nhiều cho ứng dụng của họ. Theo đó, Alkadiene sở hữu một số tính chất đặc trưng như: phản ứng ngưng tụ, phản ứng cộng, phản ứng oxy hóa halogen. Cụ thể:
2.1. Phản ứng ngưng tụ
Phản ứng ngưng tụ diễn ra theo chế độ 1,4. Tuy nhiên, cần có chất xúc tác hoặc sự có mặt của kim loại natri trong điều kiện nhiệt độ cao để phản ứng diễn ra nhanh chóng.
Phương trình phản ứng:
nCH2=CH-CH=CH2 → (-CH2-CH=CH-CH2-)n
2.2. Phản ứng oxy hóa halogen
Đây là phản ứng Ankadien điển hình. Gồm 2 phản ứng chính:
- Oxy hóa hoàn toàn ở nhiệt độ cao: 2C4H6 + 11O2 → 8CO2 + 6H2O
- Oxy hóa không hoàn toàn: Alkadiene có thể làm mất màu dung dịch KmnO4.
2.3. Phản ứng cộng
Alkadienes có phản ứng cộng với Hydro, Hydrogen Halide, Halogen. Tuy nhiên, tùy thuộc vào chất xúc tác và điều kiện mà phản ứng có thể cho kết quả khác nhau. Bao gồm:
- Phản ứng cộng hydro
Phản ứng cộng hydro với xúc tác Niken và điều kiện nhiệt độ cao:
CH2=CH – CH=CH2 + 2H2 → CH3 – CH2 – CH2 – CH3
- Phản ứng cộng hydro halogen
Tùy thuộc vào điều kiện nhiệt độ, Alkadiene có phản ứng cộng ở liên kết 1,2 hoặc 1,4:
CH2 = CH – CH = CH2 + HBr → CH3 – CH = CH – CH2Br (40 độ C)
CH2 = CH – CH = CH2 = HBr → CH2 = CH – CHBr – CH3 (-80 độ C)
- Phản ứng cộng brom
Phản ứng cộng brom ở 400C hoặc -800C:
CH2=CH-CH=CH2 + Br2 (dd) → CH2Br – CH=CH-CH2Br (400C)
CH2=CH – CH=CH2 + Br2 (dd) → CH2=CH-CHBr-CH2Br (-800C)
Ngoài ra, Ankadien còn có thể thêm vào đồng thời hai liên kết đôi:
CH2=CH – CH = CH2 + 2Br2 (dd) → CH2Br – CHBr – CHBr – CH2Br
3. Phân loại chất kiềm
Alkadienes được chia thành 3 loại khác nhau dựa vào vị trí tương đối giữa hai liên kết đôi trong cấu trúc phân tử. Cụ thể:
– Ankađien có 2 liên kết đôi cách nhau ít nhất 2 liên kết đơn. Ví dụ:
CH2 = CH-CH2-CH=CH2 (Penta – 1,4 – điện).
– Hợp chất có hai liên kết đôi đứng cạnh nhau. Ví dụ:
CH2 = C = CH2 (Anlen)
– Ankađien liên hợp bằng 2 liên kết đôi. Tuy nhiên, khoảng cách giữa các liên kết đó là một liên kết duy nhất. Ví dụ:
CH2 = CH-CH = CH2 (Butadien) hoặc CH2 = C – CH = CH2 (Isopren)
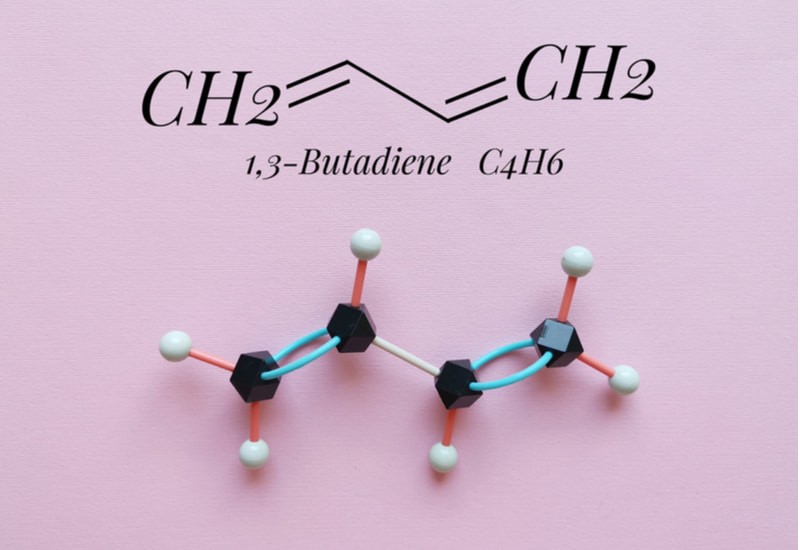
Phân loại Alkadiene dựa trên liên kết phân tử
4. Ứng dụng của Ankadien
Alkadien chủ yếu được sử dụng để sản xuất vật liệu có độ đàn hồi cao. Thông thường, Buta-1,3 diene và Isoprene có thể được điều chế thành Polibutadiene hoặc Poliisoprene thông qua quá trình trùng hợp. Các chất này là nguyên liệu để sản xuất ra các sản phẩm như Cao su Isoprene, Cao su Buna dùng làm lốp xe.

Ứng dụng làm lốp ô tô
5. Điều chế Alkadiene
Việc chuẩn bị Alkadien có thể dựa trên hai cách sau:
– Cách 1: Tách hydro khỏi Isopentane để điều chế Isoprene. Phương trình phản ứng:
CH3 – CH(CH3) – CH2 – CH3 → CH2 = C (CH3) – CH = CH2 + 2H2
– Cách 2: Dùng Butilene hoặc Butan để điều chế buta-1,3-diene.
Phương trình phản ứng:
CH3 – CH2 – CH2 – CH3 → CH2=CH-CH=CH2 + 2H2
6. Bài tập về Ankadien
Từ những kiến thức đã được chia sẻ các bạn có thể áp dụng để giải một số số Bài tập kiềm sau đó:
Bài tập 1: Phản ứng buta-1,3-diene với khí hydro. Với chất xúc tác niken trong điều kiện nhiệt độ cao. Kết thúc phản ứng thu được gì?
- Isobutilen
- Isobutan
- Pentan
- Butan
Đáp án: Đáp án đúng là D. Butan
Phương trình phản ứng: CH2=CH-CH=CH2 + 2H2 → CH3-CH2-CH2-CH3
Bài 2: Oxi hóa hoàn toàn 0,680 gam Alkadien X. Kết thúc phản ứng thu được khí CO2 ở điều kiện tiêu chuẩn là 1.120 lít. Trả lời câu hỏi sau:
Công thức phân tử của A và X là?
B, Công thức cấu tạo của X là gì?
Hồi đáp:
A, Công thức phân tử của X là CnH2n-2
Phương trình phản ứng khi X bị oxy hóa hoàn toàn là:
CnH(2n-2) + (3n-1)/2O2 → NCO2 + (n-1)H2O
Vậy: nCO2 = 1,12/22,4 = 0,05 (mol)
→ (14n – 2).0,05 = 0,68,1
→ n = 5
→ Công thức phân tử của Alkadien X là: C5H8
B, Alkadien X có thể có công thức cấu tạo sau:
CH2=CH-CH=CH-CH3
CH2=C=CH-CH2-CH3
CH3-CH=C=CH-CH3
CH2=CH-CH2-CH=CH2
CH2= C(CH)-CH = CH2
Trường Chu Văn An giới thiệu những kiến thức cơ bản về Ankadien và những đặc tính đặc trưng của hợp chất này. Nếu bạn cần tư vấn về bất kỳ loại hóa chất công nghiệp nào, vui lòng liên hệ tới đường dây nóng 0826 010 010.


Nội dung được phát triển bởi đội ngũ truongchuvananhue.edu.vn với mục đích chia sẻ và tăng trải nghiệm khách hàng. Mọi ý kiến đóng góp xin vui lòng liên hệ tổng đài chăm sóc: 1900 0000 hoặc email: hotro@truongchuvananhue.edu.vn