Nội dung bài viết
Axit sunfuric là một hợp chất hóa học rất quen thuộc với những ai đam mê hóa học. Không những vậy, nó còn được ứng dụng vào nhiều mặt trong cuộc sống, đặc biệt là trong ngành sản xuất. Vậy axit sunfuric là gì? Họ có những đặc tính gì? Và nó được ứng dụng như thế nào trong cuộc sống? Hãy cùng vietchem giải đáp thắc mắc về hợp chất hóa học này qua bài viết sau nhé!
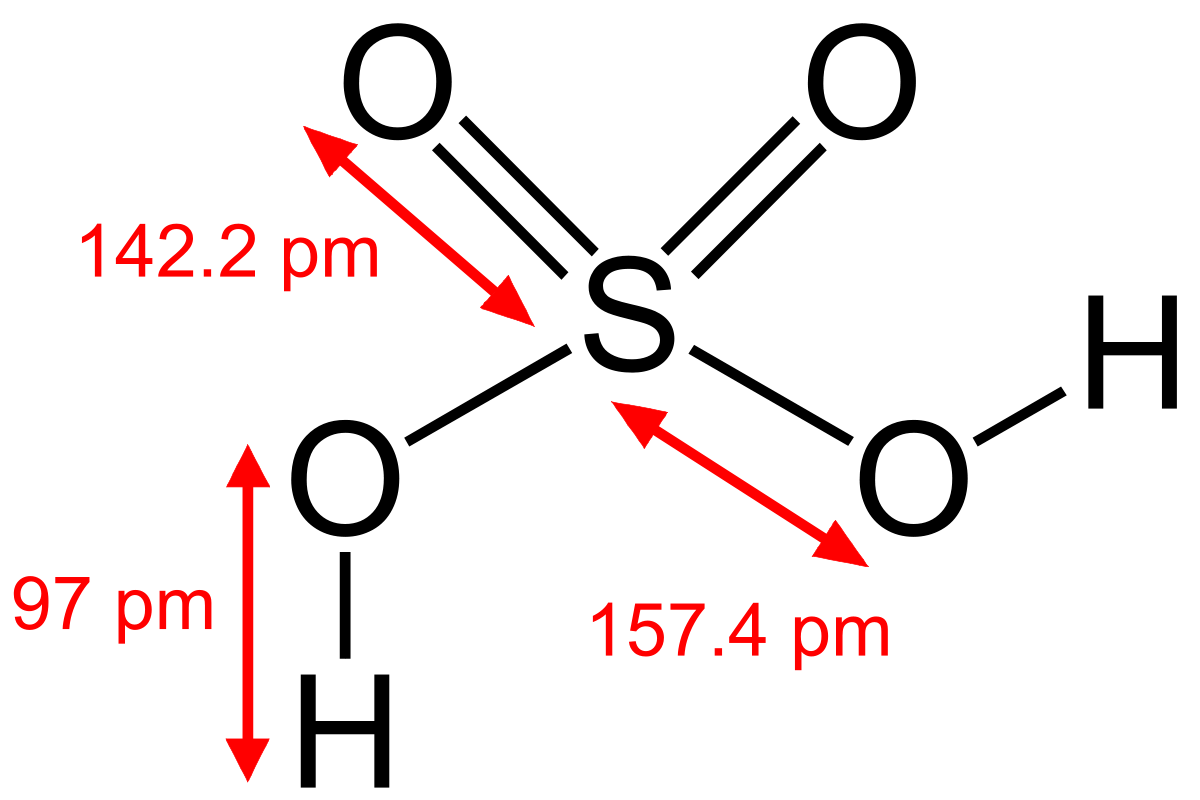
Cấu trúc phân tử axit của phân tử H2SO4
Mua hóa chất Axit Sunfuric H2SO4 95% tại đây
I. Axit sulfuric là gì?
Axit sunfuric là một axit vô cơ bao gồm các nguyên tố lưu huỳnh, oxy và hydro có công thức hóa học H2SO4. Axit sunfuric là một chất lỏng không màu, không mùi và nhớt, hòa tan trong nước và có phản ứng tỏa nhiệt cao.
1. Cấu trúc phân tử của H2SO4
-
Công thức phân tử là: H2SO4.
-
Công thức cấu tạo của H2SO4:

- Mô hình phân tử H2SO4 như sau:
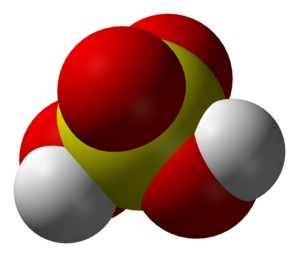
Mô hình phân tử H2SO4
2. Tính chất vật lý của axit sunfuric H2SO4
- Axit sunfuric là chất lỏng, hơi nhớt và nặng hơn nước, khó bay hơi và hòa tan vô hạn trong nước.
- Axit sulfuric đậm đặc thường hút nước mạnh và tỏa nhiều nhiệt nên khi pha loãng phải cho từ từ axit đậm đặc vào nước, không làm ngược lại, vì H2SO4 có thể gây bỏng.
- Axit sulfuric còn có khả năng cacbon hóa các hợp chất hữu cơ.
3. Tính chất hóa học của axit sunfuric H2SO4
a, Axit sunfuric loãng
Axit sunfuric là một axit mạnh, hóa chất này có đầy đủ các tính chất hóa học chung của axit như:
- Axit sunfuric H2SO4 làm đổi màu quỳ tím thành đỏ.
- Phản ứng với kim loại đứng trước H (trừ Pb) tạo thành muối sunfat.
Fe + H2SO4 → FeSO4 + H2
- Phản ứng với các oxit bazơ để tạo thành muối mới (trong đó kim loại vẫn giữ nguyên hóa trị) và nước.
FeO + H2SO4 → FeSO4 + H2O
- Axit sunfuric tác dụng với bazơ tạo thành muối và nước mới.
H2SO4 + NaOH → NaHSO4 + H2O
H2SO4 + 2NaOH → Na2SO4 + 2H2O
- H2SO4 phản ứng với muối tạo thành muối mới (trong đó kim loại vẫn giữ nguyên hóa trị) và axit mới.
Na2CO3 + H2SO4 → Na2SO4 + H2O + CO2
H2SO4 + 2KHCO3 → K2SO4 + 2H2O + 2CO2
b, Axit sulfuric đậm đặc
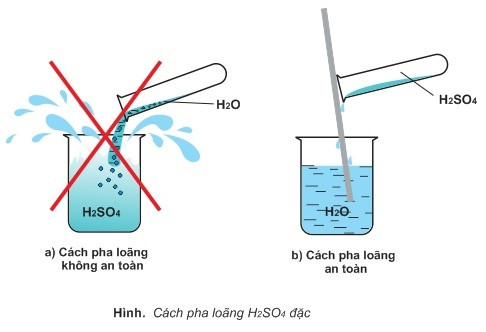
Cách pha loãng H2SO4
Axit sulfuric đậm đặc có tính axit mạnh, tính oxi hóa mạnh với các tính chất hóa học nổi bật như:
- Tác dụng với kim loại: Khi cho miếng Cu vào H2SO4 sẽ tạo ra dung dịch màu xanh lam và có khí thoát ra, có mùi rất nồng.
Cu + 2H2SO4 → CuSO4 + SO2 + 2H2O
- Phản ứng với phi kim tạo thành oxit phi kim + H2O + SO2.
C + 2H2SO4 → CO2 + 2H2O + 2SO2 (nhiệt độ)
2P + 5H2SO4 → 2H3PO4 + 5SO2 + 2H2O
- Phản ứng với các chất khử khác.
2FeO + 4H2SO4 → Fe2(SO4)3 + SO2 + 4H2O
- H2SO4 còn có tính chất ưa nước đặc trưng như cho H2SO4 vào cốc đường, sau phản ứng đường sẽ chuyển sang màu đen và phun trào theo phương trình hóa học sau.
C12H22O11 + H2SO4 → 12C + H2SO4.11H2O
4. Điều chế axit sunfuric (H2SO4)
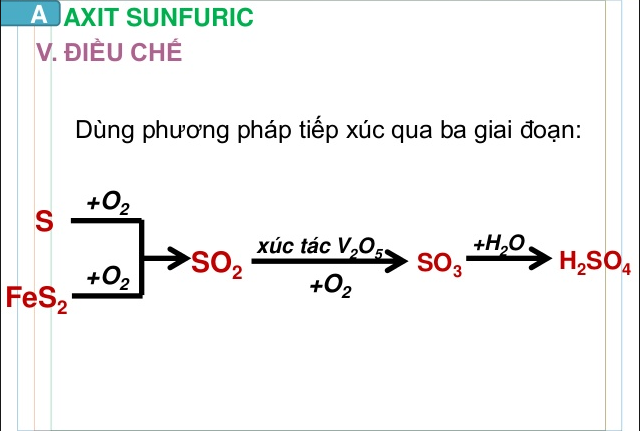
Cách điều chế axit sunfuric
Thông thường H2SO4 được tạo ra bằng cách đốt quặng sắt firit, oxy hóa SO2 bằng oxy ở nhiệt độ 400 – 500 độ C, pha loãng hóa chất oleum thành axit sulfuric với lượng nước thích hợp…
5. Các dạng axit sunfuric H2SO4
Mặc dù có thể tạo ra axit sunfuric 100% nhưng sẽ mất SO3 ở điểm sôi để tạo ra axit 98,3%. Nồng độ axit sulfuric khác nhau được sử dụng cho các mục đích khác nhau, bao gồm:
- Axit sulfuric loãng ở nồng độ 10% thường được sử dụng trong phòng thí nghiệm.
- Nồng độ H2SO4 33,5% được sử dụng cho pin.
- Axit sulfuric dùng để sản xuất phân bón có nồng độ 62,18%.
- Axit sunfuric nồng độ 77,67% được sử dụng trong tháp sản xuất hoặc axit găng tay.
- Nồng độ 98% là axit ở dạng đậm đặc.
6. Độ dẫn điện và độ phân cực của H2SO4
Axit sulfuric khan là chất lỏng phân cực, có hằng số điện môi khoảng 100. Điều này là do nó có thể phân ly bằng cách tự proton hóa, một quá trình được gọi là tự proton hóa.
Phương trình cho thấy:
2 H2SO4 → H3SO4+ + HSO4−
II. Ứng dụng của axit sunfuric H2SO4 trong đời sống
Axit sunfuric là một trong những hóa chất hàng đầu được sử dụng trong công nghiệp làm nguyên liệu thô hoặc chất xúc tác. Loại hóa chất này được sử dụng phổ biến nhất trong sản xuất phân bón, sản xuất sợi hóa học, nhựa, chất tẩy rửa, sơn,…
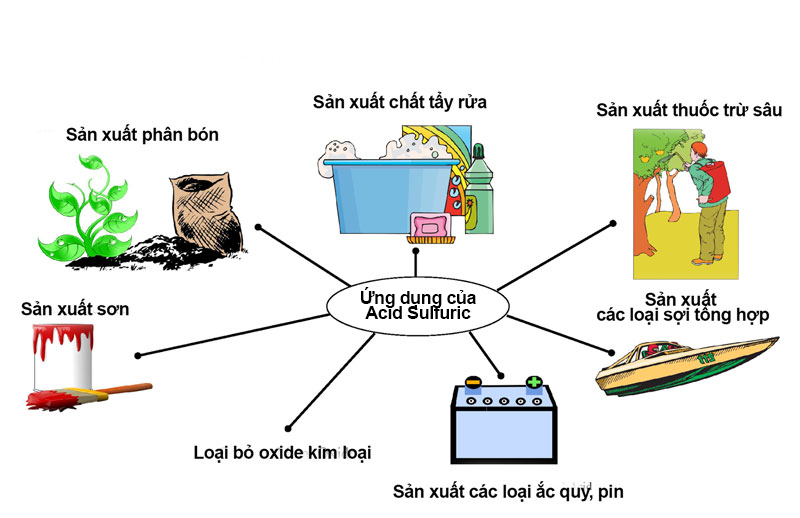
Ứng dụng của axit sunfuric
1. Trong sản xuất phân bón
Axit sunfuric chủ yếu được sử dụng để sản xuất axit photphoric, nguyên liệu thô không thể thiếu để sản xuất phân lân. Và nó cũng được sử dụng để sản xuất Amoni sunfat.
2. Trong sản xuất công nghiệp
H2SO4 được sử dụng rộng rãi trong sản xuất kim loại như đồng, kẽm,… và được dùng để làm sạch bề mặt thép và dung dịch tẩy rỉ sét.
Axit sulfuric còn được dùng để sản xuất nhôm sunfat (phèn chua làm giấy), muối sunfat, sản xuất thuốc nổ, thuốc nhuộm, nhựa, làm sạch kim loại trước khi xi mạ, sản xuất dược phẩm.
Hỗn hợp H2SO4 với nước được dùng làm chất điện phân trong pin, axit chì,…
Mỗi năm, khoảng 160 triệu tấn H2SO4 được sử dụng, đáng chú ý là trong các ngành sản xuất như phân bón 30%, chất tẩy rửa 14%, giấy, sợi 8%, nhựa 5%, luyện kim 2%, thuốc nhuộm 2%,…
3. Trong xử lý nước thải
Axit sulfuric được dùng để sản xuất nhôm hydroxit, chất dùng trong các nhà máy xử lý nước để lọc tạp chất, cải thiện mùi vị của nước, trung hòa độ pH trong nước, loại bỏ Ca2+ và Mg2+ trong nước. rác thải.
Lưu ý: Về tác hại của axit sulfuric, đây là loại hóa chất nguy hiểm, có tính ăn mòn loại 1 và gây phồng rộp da. Vì vậy, khi sử dụng bạn nên trang bị đầy đủ các dụng cụ chuyên dụng, mặt nạ phòng độc cá nhân, khẩu trang, mũ pha trộn…

Axit sunfuric được sử dụng trong quá trình xử lý nước thải công nghiệp
4. Trong phòng thí nghiệm
Axit sunfuric là hợp chất đậm đặc dùng để điều chế các axit yếu hơn: HNO3. HCl tham gia thí nghiệm.
Nó là chất hóa học không thể thiếu trong các phản ứng nhằm tạo ra kết quả và ứng dụng trong các lĩnh vực khác của đời sống.
III. Những lưu ý khi sử dụng và bảo quản H2SO4
1. Những lưu ý khi sử dụng H2SO4
Khi sử dụng, bạn cần pha loãng axit sunfuric với nước, sau đó cho từ từ axit vào nước rồi khuấy đều, tuyệt đối không làm ngược lại. Nên sử dụng găng tay, kính bảo hộ khi tiếp xúc với H2SO4 loãng và khi tiếp xúc với axit đậm đặc phải sử dụng tấm che mặt và tạp dề PVC để đảm bảo an toàn tối đa.
2. Lưu ý khi bảo quản
Vì chúng là axit rất mạnh nên phải tránh xa các bazơ và chất khử. Nó là chất ăn mòn mạnh ngay cả khi được pha loãng và ăn mòn nhiều kim loại như sắt và nhôm.
IV. Chọn mua hóa chất lưu huỳnh ở đâu chất lượng?
Tôi nên mua axit sunfuric ở đâu?
Chắc hẳn đây là câu hỏi của rất nhiều người đang tìm nơi bán hóa chất axit sunfuric chất lượng nên chọn mua axit sunfuric tại vietchem – một trong những địa chỉ tin cậy chuyên cung cấp hóa chất công nghiệp. công nghiệp, hóa chất tinh khiết uy tín. Trong đó, hóa chất axit sulfuric được sử dụng rộng rãi để trung hòa pH trong xử lý nước thải, dùng để loại bỏ các ion Mg2+, Ca2+ trong nước thải và được sử dụng trong sản xuất, chế biến phân bón. quặng, tổng hợp hóa học, lọc dầu…
Đây là địa chỉ bán axit sulfuric với giá tốt nhất thị trường. Không chỉ vậy, khách hàng còn nhận được sự tư vấn tận tình, dịch vụ giao hàng nhanh chóng chuyên nghiệp, hàng hóa đến tay khách hàng một cách nhanh nhất.
Không chỉ hóa chất xử lý nước, vietchem còn phân phối các loại hóa chất công nghiệp khác như:
- Dung môi công nghiệp.
- Hóa chất sản xuất điện tử.
- Hóa chất khai thác mỏ.
- Hóa chất nhiệt điện.
- Hóa chất trong ngành thực phẩm.
- Hóa chất ngành xi mạ.
- Hóa chất ngành dệt nhuộm.
- Hóa chất bảo trì.
Hy vọng bài viết trên giúp mọi người hiểu rõ hơn về đặc điểm, tính chất, ứng dụng và địa chỉ bán hàng axit sulfuric chất lượng tốt nhất. Liên hệ ngay với WORLDCHEM theo số HOTLINE 0826 010 010 hoặc truy cập TẠI ĐÂY để được tư vấn, báo giá và đặt hàng nhanh nhất!
Xem thêm: THỦY TRỊ ĐO Nồng độ ACID H2SO4 TRONG BỒN THU


Nội dung được phát triển bởi đội ngũ truongchuvananhue.edu.vn với mục đích chia sẻ và tăng trải nghiệm khách hàng. Mọi ý kiến đóng góp xin vui lòng liên hệ tổng đài chăm sóc: 1900 0000 hoặc email: hotro@truongchuvananhue.edu.vn