Nội dung bài viết
Điều chế axit clohiđric HCl trong phòng thí nghiệm. HCl còn được gọi là dung dịch axit clohiđric. Là một chất hóa học quan trọng đang đóng vai trò quan trọng trong nhiều ngành công nghiệp. Từ sản xuất hóa chất đến xử lý nước và nông nghiệp. Hôm nay Hóa chất Vũ Hoàng sẽ giới thiệu đến mọi người phương pháp điều chế HCl trong phòng thí nghiệm. Để mọi người biết thêm về tính chất và cách điều chế dung dịch này mời các bạn cùng chúng tôi tìm hiểu bài viết Điều chế axit clohydric HCl trong phòng thí nghiệm dưới đây.
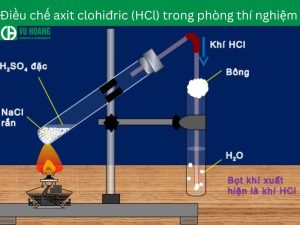 Điều chế axit clohydric HCl trong phòng thí nghiệm
Điều chế axit clohydric HCl trong phòng thí nghiệm
Tìm hiểu một chút về axit clohiđric:
Axit clohydric là gì?
Axit clohydric là sản phẩm vô cùng quen thuộc trong đời sống và sản xuất ngày nay. Nó là một hợp chất vô cơ có tính axit mạnh tồn tại ở cả dạng lỏng và khí.
Nó có công thức hóa học là HCl và được biết đến với nhiều tên gọi khác nhau. Chẳng hạn như: Axit clohydric, Axit clohiđric, Axit Muriatic, Cloran.
Cấu trúc hóa học của phân tử HCl:
Về mặt cấu trúc, liên kết giữa nguyên tử H và nguyên tử Cl trong axit HCl là liên kết cộng hóa trị có cực. Nguyên nhân là do độ âm điện của Clo lớn hơn nên cặp electron dùng chung bị lệch về phía nguyên tử Cl.
Tính chất vật lý:
- Ở dạng khí, HCL không màu, có mùi nồng, tan trong nước tạo thành dung dịch axit HCl mạnh. Nặng hơn không khí.
- Đối với dung dịch axit HCl loãng không màu, dung dịch HCl đậm đặc nhất có nồng độ tối đa 40% và có màu vàng lục. Ở dạng đậm đặc axit này có thể tạo thành sương mù axit.
- Độ hòa tan trong nước: 725 g/L ở 20°C.
- Trọng lượng phân tử: 36,5 g/mol.
- HCL là dung dịch không cháy nhưng dễ bay hơi.
Tính chất hóa học:
– Là axit mạnh: HCl là axit mạnh trong nước. Điều đó có nghĩa là nó có khả năng tạo ra proton (H+) mạnh khi hòa tan trong nước.
– Phản ứng với kim loại kiềm: HCl phản ứng với kim loại kiềm như natri hoặc kali tạo ra muối và khí hydro.
2HCl + 2Na → 2NaCl + H2
– Phản ứng với bazơ: HCl còn phản ứng với bazơ tạo thành muối và nước
HCl + NaOH → NaCl + H2O
Xem thêm: >>> Mua axit HCL 32% ở đâu chất lượng và giá TỐT
Điều chế HCl trong phòng thí nghiệm:
Trong nghiên cứu và thí nghiệm hóa học, phương pháp sunfat đã trở thành một trong những phương pháp phổ biến. Để điều chế được HCl có nồng độ cao có thể đạt tới 40%. Phương pháp này thường sử dụng axit sunfuric đậm đặc và muối clorua. Để tạo ra dung dịch axit clohydric chất lượng cao.
Phương trình điều chế HCl trong phòng thí nghiệm bằng phương pháp sunfat như sau:
NaCl rắn + H2SO4 đậm đặc → NaHSO4 + HCl (
2NaCl rắn + H2SO4 đậm đặc → Na2SO4 + 2HCl (> 400 độ C)
Trong quá trình thí nghiệm, khí HCl sinh ra được dẫn qua nước thu được Axit clohydric. Hiện nay, phương pháp Sulfate không được sử dụng để điều chế HBr và HI. Vì Axit Sunfuric sẽ oxy hóa HBr và HI thành Br2 và I2. Làm thất thoát bromua và iodua trong quá trình điều chế. Cụ thể phản ứng oxi hóa khử như sau:
H2SO4 đậm đặc + 2HBr → SO2 + Br2 + 2H2O
H2SO4 + 2HI đậm đặc → SO2 + I2 + 2H2O
Điều chế HCl bằng cách cho kim loại kiềm phản ứng với axit clohiđric. Đây là cách điều chế HCl trong phòng thí nghiệm để có nồng độ HCl thấp hơn phương pháp trên. Khi thực hiện thí nghiệm, các kim loại kiềm như Li, Na, K, Rb,… có tính khử mạnh. Khi phản ứng với Axit clohiđric sẽ tạo ra muối Clorua và khí Hydro.
 HCl được chiết từ phòng thí nghiệm
HCl được chiết từ phòng thí nghiệm
Ưu điểm của phương pháp điều chế HCL bằng sunfat:
– Hiệu suất cao: Phương pháp sunfat cho phép sản xuất HCl với nồng độ lên tới 40%. Giúp tối ưu hóa nguyên liệu và năng lực sản xuất.
– Không sử dụng chất trung gian: So với một số phương pháp khác không cần thêm chất trung gian. Giảm nguy cơ tạo ra dư lượng không mong muốn.
– Độ an toàn cao: Công nghệ phản ứng này thường được kiểm soát chặt chẽ. Giảm nguy cơ tai nạn và tăng cường an toàn trong phòng thí nghiệm.
Phương pháp này có phương trình điều chế HCl sau:
M + HCl → MCl + H2
Trong đó: M là kim loại kiềm
Trong quá trình thí nghiệm, khí hydro sinh ra có thể được thu hồi hoặc đốt cháy tùy theo nhu cầu sử dụng. HCl sẽ được hấp thụ vào nước thu được dung dịch Axit clohydric. Ngoài 2 cách điều chế HCl trên mà chúng tôi chia sẻ. Bạn có thể tham khảo một số cách khác như:
- Để các hợp chất clorua như C2C2H5Cl, NH4Cl, ICl,… phản ứng được với các axit mạnh như HNO3, H2SO4…
- Để các hợp chất clorua chứa kim loại quý như AgCl,… phản ứng với các chất khử mạnh như Zn, Al…
- Để các hợp chất clorua kim loại kiềm như NaClO3, KClO4… phản ứng được với các axit mạnh như H2SO4, H3PO4…
Tuy nhiên, những phương pháp điều chế HCl trong phòng thí nghiệm này hiếm khi được sử dụng. Do chi phí cao, hiệu quả thấp hoặc nguy hiểm trong quá trình thực hiện.
Xem thêm bài viết: >>> Mua Axit HCl pha loãng
Những lưu ý khi pha chế axit clohydric:
– Sử dụng các thiết bị bảo hộ như kính, găng tay, quần áo bảo hộ và giày để bảo vệ cơ thể khỏi tiếp xúc với hóa chất.
– Thực hiện ở khu vực có hệ thống chân không hoặc quạt hút để loại bỏ khói, hơi có thể gây kích ứng.
– Cần kiểm soát nhiệt độ quá trình để tránh hiện tượng nóng chảy đột ngột hoặc phản ứng quá nhanh.
– Cho axit vào nước từ từ để tránh tạo nhiệt độ cao.
– Kiểm tra tình trạng dụng cụ, thiết bị trước khi sử dụng để đảm bảo không bị hư hỏng, ố vàng do tác động của axit clohydric.
– HCl là chất dễ cháy nên phải xử lý cẩn thận để tránh gây cháy, nổ.
– Tránh va đập hoặc va đập vào bình đựng axit clohydric để tránh chất bị rò rỉ hoặc gây nổ.
– Tìm hiểu tính chất hóa học và độ an toàn của axit clohiđric trước khi bắt đầu quá trình pha chế.
– Thường xuyên bảo trì các thiết bị, dụng cụ được sử dụng để đảm bảo chúng luôn trong tình trạng hoạt động tốt.
– Bảo quản axit clohydric ở nơi khô ráo, thoáng mát, tránh ánh sáng trực tiếp.
 Nhà máy hóa chất HCl
Nhà máy hóa chất HCl
Mua HCl ở đâu giá TỐT?
Trên đây là những chia sẻ của Vũ Hoàng Chemical về cách điều chế HCl. Hy vọng nó sẽ giúp các bạn hiểu rõ hơn về quy trình điều chế Axit Sunfuric trong thí nghiệm. Hóa chất Lộc Thiện cung cấp sỉ và lẻ các loại hóa chất cơ bản: FeCl2, FeCl3, NaOH, Javen, Ca(OH)2, H2SO4,… chất lượng cao với giá cạnh tranh nhất. Để mua HCl giá rẻ bạn chỉ cần liên hệ HOTLINE hoặc Website https://vuhoangco.com.vn. Đội ngũ nhân viên của chúng tôi sẽ hỗ trợ tư vấn và báo giá cạnh tranh nhất tới khách hàng.
Chúng tôi đảm bảo các sản phẩm cung cấp luôn đảm bảo chất lượng và có nguồn gốc xuất xứ rõ ràng. Hơn nữa, đảm bảo đóng gói, vận chuyển và giao đến tay khách hàng những sản phẩm có chất lượng tốt nhất.


Nội dung được phát triển bởi đội ngũ truongchuvananhue.edu.vn với mục đích chia sẻ và tăng trải nghiệm khách hàng. Mọi ý kiến đóng góp xin vui lòng liên hệ tổng đài chăm sóc: 1900 0000 hoặc email: hotro@truongchuvananhue.edu.vn