Nội dung bài viết
Trong bảng tuần hoàn các nguyên tố hóa học, nhóm halogen là nhóm các nguyên tố hóa học được sử dụng rộng rãi trong đời sống. Vậy Halogen là gì? Chúng có những đặc tính nổi bật nào và được ứng dụng như thế nào trong các lĩnh vực khác nhau? Hãy cùng Trường Chu Văn An giải đáp thắc mắc về Halogen qua bài viết dưới đây nhé!
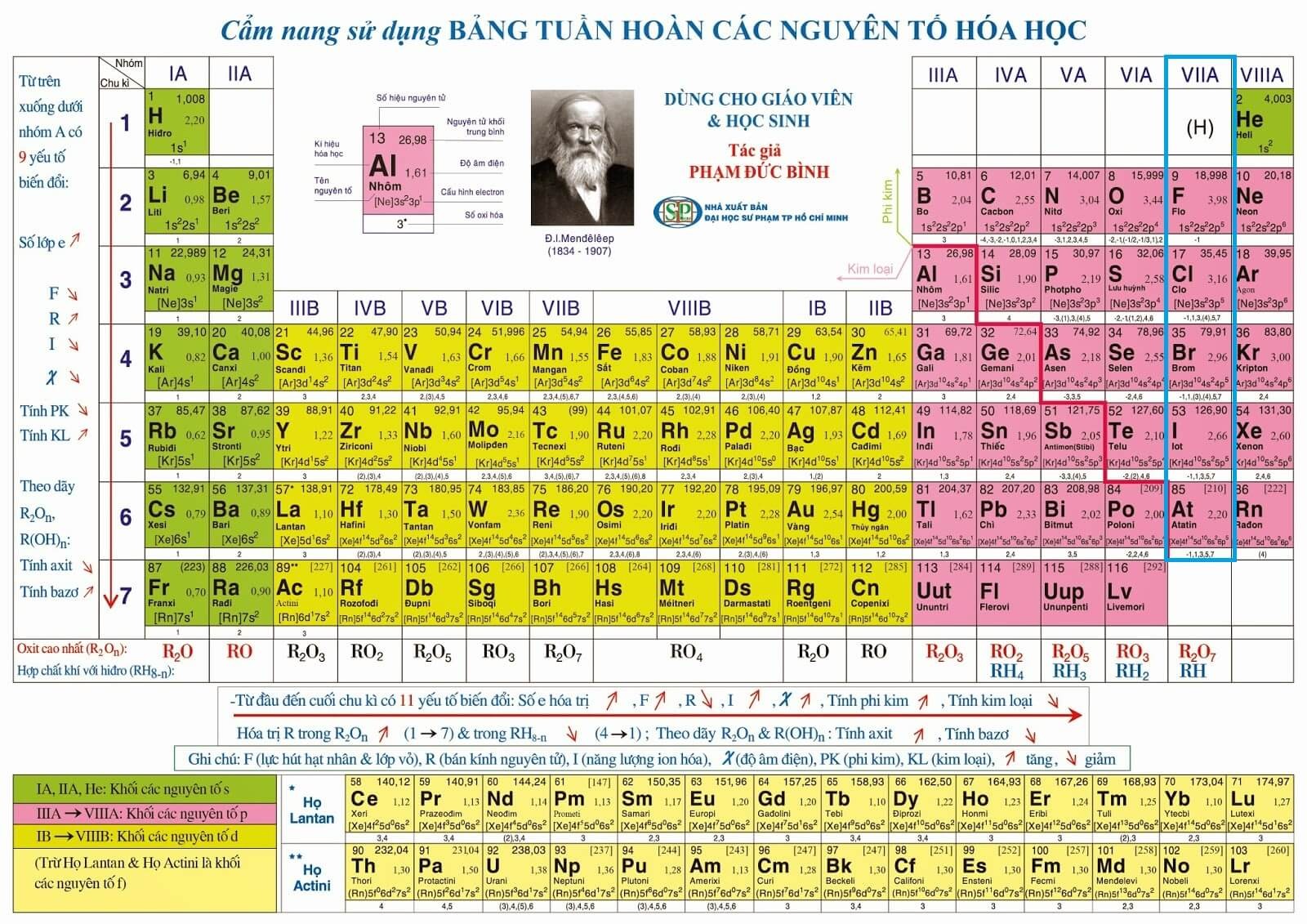
1. Halogen là gì?
Halogen là các nguyên tố thuộc nhóm VIIA trong bảng tuần hoàn, thường được gọi là nhóm halogen hay nguyên tố halogen. Nhóm này bao gồm các nguyên tố hóa học như: Fluorine (F), Chlorine (Cl), Brom (Br), Iodine (I), Astatine (At là nguyên tố phóng xạ, hiếm khi được tìm thấy trong tự nhiên ở vỏ Trái Đất), Tennessine (Ts là một nguyên tố mới được phát hiện).
Halogen là gì?
2. Cấu trúc phân tử của nhóm halogen
- Lớp electron ngoài cùng của các nguyên tố halogen đều có 7 electron, được chia thành 2 lớp con (phân lớp s có 2 electron, lớp p có 5 electron).
- Do có 7 electron ở lớp ngoài cùng nên chỉ thiếu 1 electron để đạt được cấu hình electron ổn định giống như khí hiếm nên ở trạng thái tự do, hai nguyên tử halogen dùng chung một cặp electron tạo nên phân tử có liên kết cộng hóa trị. Hóa trị không phân cực.
- Liên kết của phân tử (X_{2}) không mạnh lắm, chúng dễ dàng bị tách thành hai nguyên tử X. Trong phản ứng hóa học, các nguyên tử này dễ dàng nhận thêm electron nên tính chất hóa học cơ bản của halogen là chất oxy hóa mạnh.
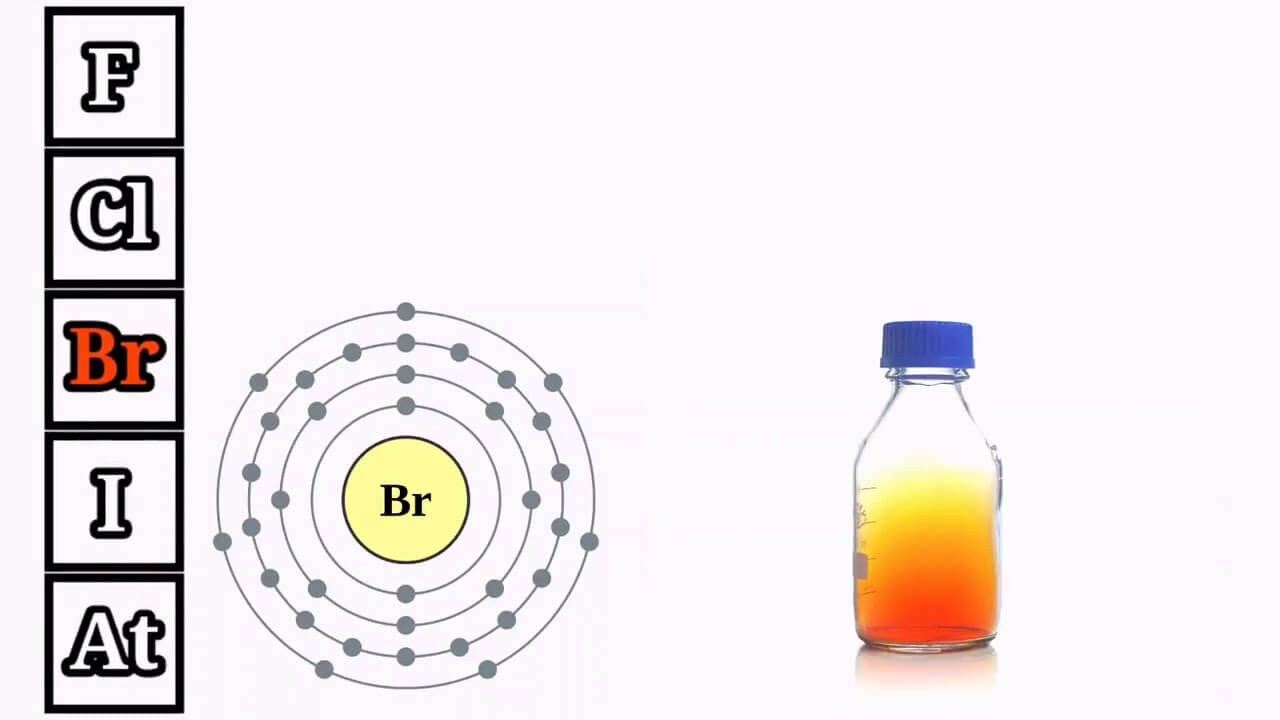
Cấu trúc phân tử của Br thuộc nhóm halogen
3. Tính chất vật lý của halogen
- Trạng thái và màu sắc: Trạng thái của các nguyên tố halogen sẽ từ khí, lỏng đến rắn và màu sẽ đậm dần như sau: Flo khí có màu vàng lục, Clo khí có màu vàng lục, Brom lỏng có màu nâu đỏ, Iod ở dạng rắn có màu tím đen, dễ thăng hoa.
- Nhiệt độ nóng chảy, nhiệt độ sôi: Tăng dần từ Flo (F) đến Iot (I).
- Đặc điểm hòa tan trong nước: Ngoài flo không tan trong nước, các chất còn lại trong nhóm halogen tương đối khó tan và chủ yếu tan trong một số dung môi hữu cơ.
- Trong tự nhiên chỉ tồn tại ở dạng hợp chất: Clo (Cl) chủ yếu tồn tại ở dạng muối clorua, Flo (F) thường tồn tại ở dạng khoáng fluorit và cryolit, Brom (Br) chủ yếu tồn tại ở dạng muối bromua của kali, Natri và magie. , iốt (I) được tìm thấy trong mô của một số loài rong biển và tuyến giáp của con người…

Tính chất vật lý của halogen
4. Tính chất hóa học của nhóm halogen
- Vì lớp electron ngoài cùng đã có sẵn 7e nên halogen là phi kim điển hình nên dễ nhận thêm 1e để thể hiện tính oxi hóa mạnh.
- Tính oxi hóa của nhóm halogen sẽ giảm dần khi đi từ F2 đến I2.
- Trong số các hợp chất, F chỉ có trạng thái oxi hóa -1; Ngoài ra, các halogen khác ngoài mức oxi hóa -1 còn có mức +1; +3; +5; +7.
5. Một số phản ứng minh họa tính chất của halogen
Phản ứng với kim loại
- Các halogen phản ứng với hầu hết các kim loại ngoại trừ Au và Pt (riêng F2 phản ứng với tất cả các kim loại) → muối halogenua. Phản ứng thường xảy ra ở nhiệt độ cao.
2M + nX2 → 2MXn
- Muối thu được thường tương ứng với mức hóa trị cao nhất của kim loại. Riêng Fe phản ứng với I2 chỉ tạo ra FeI2.
Phản ứng với hydro
- Halogen phản ứng với hydro tạo thành hydro halogenua
H2 + X2 → 2HX
Với điều kiện:
- F2: Phản hồi ngay cả trong bóng tối.
- Cl2: Chỉ phản ứng khi tiếp xúc với ánh sáng.
- Br2: Phản ứng xảy ra khi đun nóng ở nhiệt độ cao.
- I2: Là phản ứng thuận nghịch nên phải đun nóng.
Phản ứng với nước
- F2 phản ứng mạnh với nước theo phương trình sau:
2H2O + 2F2 → 4HF + O2
- Br2 và Cl2 phản ứng thuận nghịch với nước:
H2O + X2 ↔ HX + HXO (axit hydrohalogen và axit hypohalogen)
H2O + Cl2 ↔ HCl + HClO
- I2 không phản ứng với nước.
Phản ứng với dung dịch kiềm
- Dung dịch kiềm loãng lạnh:
X2 + 2NaOH → NaX + NaXO + H2O
Cl2 + 2NaOH → NaCl + NaClO + H2O
Dung dịch 2Cl2 + 2Ca(OH)2 → CaCl2 + Ca(ClO)2 + 2H2O
Bột Cl2 + Ca(OH)2 → CaOCl2 + H2O
- Chỉ F2:
2F2 + 2NaOH → 2NaF + H2O + OF2
- Dung dịch kiềm đậm đặc nóng:
3X2 + 6KOH → 5KX + KXO3 + 3H2O
3Cl2 + 6KOH → 5KCl + KClO3 + 3H2O (1000C)
Phản ứng với dung dịch muối halogenua
X2 + 2NaX' → 2NaX + X'2
(Trong đó X' là halogen có tính oxi hóa yếu hơn halogen X. F2 không có phản ứng này).
6. Ứng dụng quan trọng của nhóm halogen
6.1 Tạo đèn halogen
- Đèn halogen là một loại bóng đèn sợi đốt bao gồm một dây vonfram được bọc kín trong bóng đèn compact với hợp chất khí trơ và một lượng nhỏ halogen như brom hoặc iốt.
- Sự kết hợp giữa khí halogen và sợi vonfram sẽ tạo ra phản ứng hóa học theo chu trình halogen, giúp bổ sung vonfram vào dây tóc, từ đó duy trì độ trong suốt của vỏ bóng đèn và tăng tuổi thọ của bóng đèn.
- Bóng đèn halogen có khả năng hoạt động ở nhiệt độ cao hơn so với các loại đèn nạp khí thông thường có công suất và tuổi thọ tương đương. Đồng thời, loại bóng đèn này cho ra ánh sáng có nhiệt độ màu và hiệu suất chiếu sáng cao hơn.

đèn halogen
6.2 Ứng dụng halogen trong điện tử và vật liệu
Không chứa halogen thường được sử dụng làm chất chống cháy và được sử dụng trong các linh kiện và vật liệu điện tử, vỏ sản phẩm và nhựa.
Lưu ý: Loại chất chống cháy này không thể tái chế được, nó sẽ thải ra các chất độc hại trong quá trình đốt cháy và sưởi ấm, đe dọa sức khỏe con người và môi trường xung quanh.

Ứng dụng trong điện tử và vật liệu
>>>XEM THÊM:  : Kali clorat là gì? Đặc điểm, tính chất và ứng dụng quan trọng của chúng
: Kali clorat là gì? Đặc điểm, tính chất và ứng dụng quan trọng của chúng
6.3 Ứng dụng của halogen trong y học
Ứng dụng của iốt:
-
Iốt bôi tại chỗ (5% iốt trong nước/etanol) để khử trùng vết thương hoặc khử trùng bề mặt nước uống.
-
Iốt-123 được sử dụng trong y học để chụp ảnh và kiểm tra hoạt động của tuyến giáp.
-
Iốt-131 giúp điều trị ung thư tuyến giáp và bệnh Grave, đồng thời cũng được sử dụng trong chụp ảnh tuyến giáp.
Ứng dụng của Flo:
Hiện nay, các hợp chất dược phẩm có chứa flo được sử dụng rộng rãi trên thị trường. Ví dụ: Thuốc chống trầm cảm như Prozac và Paxil, thuốc chống viêm khớp và thuốc chống viêm tổng hợp như Celebrex, thuốc chống nhiễm trùng như Cipro…

Ứng dụng của halogen trong y học
Hy vọng với những chia sẻ trên các bạn đã hiểu rõ hơn về halogen, nhóm halogen cũng như những tính chất, ứng dụng quan trọng của chúng. Nếu có thắc mắc vui lòng bình luận bên dưới bài viết này để nhận được câu trả lời chi tiết hơn từ các chuyên gia Trường Chu Văn An.




Nội dung được phát triển bởi đội ngũ truongchuvananhue.edu.vn với mục đích chia sẻ và tăng trải nghiệm khách hàng. Mọi ý kiến đóng góp xin vui lòng liên hệ tổng đài chăm sóc: 1900 0000 hoặc email: hotro@truongchuvananhue.edu.vn