Nội dung bài viết
HCl hóa học là gì? Tìm hiểu tính chất hóa học của HCl. Nó có hòa tan trong nước không? Quỳ xanh có đổi màu không? Chất điện phân mạnh hay yếu? Đây là những câu hỏi Vũ Hoàng nhận được rất nhiều liên quan đến chủ đề Axit Clohydric. Với sản lượng sản xuất lên tới 20 triệu tấn/năm, axit clohydric là nguồn nguyên liệu khá phổ biến và có tính ứng dụng cao đối với con người. Tuy nhiên, với đặc tính là axit mạnh nên đây vẫn là một loại hóa chất độc hại. Hãy cùng Vũ Hoàng tìm hiểu qua bài viết “HCl hóa học là gì? Tìm hiểu về tính chất hóa học của HCl” dưới đây nhé!
 HCl hóa học là gì? Tìm hiểu tính chất hóa học của HCl
HCl hóa học là gì? Tìm hiểu tính chất hóa học của HCl
Khái niệm hóa học của HCl là gì?
Axit clohydric hay còn gọi là axit muriatic… (ký hiệu hóa học: HCl). Khi ở dạng khí, axit HCl không màu, có mùi nồng, nặng hơn không khí và tan nhiều trong nước tạo thành dung dịch HCl có tính axit mạnh.
Khi ở dạng lỏng, axit HCl là dung dịch loãng, không màu, dễ bay hơi nhưng không bắt lửa.
Nồng độ axit HCl đậm đặc tối đa là 40%, lúc này dung dịch có màu hơi vàng. Có khả năng tạo thành sương mù axit trong môi trường không khí ẩm.
Theo Wikipedia, axit clohydric là một axit vô cơ mạnh, được tạo ra từ sự hòa tan trong nước của khí hydro clorua (HCl). Do đó, nó có tất cả các tính chất hóa học của một axit mạnh. Cụ thể như sau:
- Làm đổi màu quỳ tím
- Là chất điện li mạnh
- Hiệu quả với kim loại, muối, bazơ, oxit kim loại và các chất có tính oxy hóa cao.
Tính chất hóa học của hóa chất HCl
HCl làm quỳ tím chuyển sang màu gì?
Vì là axit mạnh nên HCl làm quỳ tím chuyển sang màu đỏ khi tiếp xúc. Đây cũng là đặc điểm nhận dạng rõ ràng nhất của hầu hết các axit mạnh.
Tuy nhiên, xin lưu ý rằng hợp chất này chỉ làm quỳ tím đổi màu khi tồn tại ở dạng dung dịch. Nếu tồn tại ở thể khí thì không làm quỳ tím chuyển sang màu đỏ.
Xem thêm: >>> Axit clohydric HCl dùng làm chất tẩy rửa như thế nào?
Đó là chất điện li mạnh
Axit clohydric tan hoàn toàn trong nước và khi hòa tan nó phân ly tạo thành một ion H+ và một ion Cl−. Vì axit này có khả năng phân ly hoàn toàn trong nước nên được coi là chất điện ly mạnh. Vì vậy, một chất được gọi là chất điện li mạnh khi tan hoàn toàn hoặc gần như hoàn toàn trong nước. Đồng thời, các phân tử hòa tan phân ly thành các ion.
Trong quá trình hòa tan trong nước, ion H+ liên kết với H2O tạo thành ion H3O+. phương trình:
- HCl + H2O → H3O+ + Cl–
HCL tác dụng được với những chất nào?
Phản ứng với kim loại
Các kim loại phản ứng được với HCl là những kim loại đứng trước Hydro trong bảng tuần hoàn như Fe, Al, Mg. Phản ứng tạo ra muối clorua và giải phóng khí hydro. Phương trình phản ứng như sau:
- 2HCl + Mg → MgCl2 + H2↑
- Fe + 2HCl → FeCl2 + H2↑
- 6HCl + 2Al → 2AlCl3 + 3H2↑
Phản ứng với oxit bazơ:
Axit clohydric phản ứng với các oxit bazơ tạo thành muối clorua và nước.
ZnO + 2HCl → ZnCl2 + H2O
Tương tác với muối
Axit clohydric cũng có thể phản ứng với muối, tạo ra muối mới và axit mới. Điều kiện để phản ứng xảy ra là axit sinh ra phải yếu hơn HCl thì sản phẩm kết tủa hoặc tạo ra khí bay lên. Phương trình phản ứng như sau:
- Na2CO3 + 2HCl → 2NaCl + H2O + CO2↑
- CaCO3 + 2HCl → CaCl2 + H2O + CO2↑
- AgNO3 + 2HCl → AgCl↓ + HNO3
- 2HCl + BaS → BaCl2 + H2S↑
- K2CO3 + 2HCl → 2KCl + H2O + CO2↑
Phản ứng với bazơ
HCl tác dụng với bazơ tạo thành muối và nước. Phương trình phản ứng như sau:
- 2HCl + 2NaOH → 2NaCl + H2O
- 2HCl + Ca(OH)2 → CaCl2 + 2H2O
- 2HCl + Fe(OH)2 → FeCl2 + 2H2O
Phản ứng với các hợp chất oxy hóa
Ngoài khả năng oxy hóa khi phản ứng với kim loại trước Hydro, Axit HCl còn có khả năng phản ứng với các chất oxy hóa mạnh như KMnO4, K2Cr2O7, MnO2, KClO3,… Trong phản ứng này, nó đóng vai trò là chất khử mạnh. Phương trình phản ứng:
Axit clohydric có tính chất khử
Axit này thể hiện tính khử khi phản ứng với các chất oxy hóa mạnh như KMnO4, K2Cr2O7, MnO2, KClO3,…
- 2HCl + MnO2→ MnCl2 + Cl2 + H2O
- 16HCl + KMnO4→ 2KCl + 2MnCl2 + 5Cl2 + 8H2O
- 14HCl + K2CrO7 → 2KCl2 + 2CrCl3 + 3Cl2 + 7H2O
- 6HCl + KClO3→ KCl + 3CL2+ 3H2O
Vì axit clohiđric có tính oxi hóa
Axit này có tính oxi hóa khi tác dụng với kim loại đứng trước H2
- 2HCl + Mg → MgCl2 + H2↑
- Fe + 2HCl → FeCl2 + H2↑
- 6HCl + 2Al → 2AlCl3 + 3H2↑
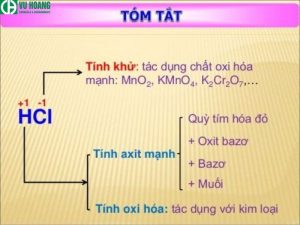 Tóm tắt tính chất hóa học của HCl
Tóm tắt tính chất hóa học của HCl
HCl không phản ứng được với chất nào?
Ngoài những hợp chất có tác dụng với HCl mà Bilico chia sẻ ở trên, dưới đây là một số chất không có tác dụng:
- Kim loại đứng sau Hydro trong dãy điện hóa là Cu. Ách, Âu,….
- Muối không tan: Muối gốc CO3 và PO4 nhưng không bao gồm K2CO3 và Na2CO3,K3PO4 và Na3PO4)
- Axit: Không hoạt động với tất cả các axit
- Phi kim loại: Không hoạt động với phi kim loại
- Oxit kim loại: Không phản ứng được với oxit kim loại
- Oxit phi kim loại: Không thể phản ứng với oxit phi kim loại
Xem thêm: >>> Tác dụng của Axit HCl đối với đời sống con người
Lưu ý trong quá trình bảo quản và sử dụng hóa chất HCl
Tính chất hóa học của HCl cho thấy đây là hợp chất độc hại có thể gây ra những ảnh hưởng có hại cho sức khỏe con người. Vì vậy, trong quá trình bảo quản và sử dụng hóa chất này, chúng ta cần đặc biệt chú ý những điều sau:
Đang lưu trữ– Sử dụng thùng chứa có khả năng chống ăn mòn axit. – Không để gần chất dễ cháy nổ, chất oxy hóa. – Bảo quản hóa chất ở nơi thoáng mát, tránh nước và ánh nắng trực tiếp.
Khi sử dụng– Cần trang bị đầy đủ các thiết bị bảo hộ, tránh tiếp xúc trực tiếp với hóa chất. – Dùng nước để xử lý và súc rửa trong trường hợp axit bị đổ ra ngoài hoặc văng vào cơ thể. – Kiểm tra nồng độ các thành phần trong nước thường xuyên. Không sử dụng nước hồ bơi ngay sau khi thêm hóa chất xử lý.
 An toàn khi sử dụng hóa chất HCl
An toàn khi sử dụng hóa chất HCl
Kết luận :
Như vậy, Vũ Hoàng vừa chia sẻ và giải đáp mọi thắc mắc của các bạn về tính chất hóa học của axit clohydric. Hy vọng những thông tin chia sẻ trong bài có thể giúp bạn cập nhật thêm một số thông tin về loại axit này.
Quý khách hàng có nhu cầu mua hóa chất HCl vui lòng liên hệ công ty hóa chất Vũ Hoàng để được tư vấn và thông tin về giá cả. Cam kết sản phẩm chất lượng, giá cả hợp lý, nguồn cung ổn định, thời gian giao hàng nhanh.


Nội dung được phát triển bởi đội ngũ truongchuvananhue.edu.vn với mục đích chia sẻ và tăng trải nghiệm khách hàng. Mọi ý kiến đóng góp xin vui lòng liên hệ tổng đài chăm sóc: 1900 0000 hoặc email: hotro@truongchuvananhue.edu.vn