Nội dung bài viết
Khí hiếm là một nhóm các nguyên tố thuộc nhóm 18 của bảng tuần hoàn. Điều đặc biệt là khí hiếm không phản ứng hóa học với các chất khác trong môi trường. Vậy quý độc giả hãy cùng ENGCHEM tìm hiểu về loại hợp chất này, tính chất cũng như ứng dụng của nó trong cuộc sống.
1. Khí hiếm – khí trơ là gì?
Khí quý hay còn gọi là khí trơ là tên gọi chung khi đề cập đến các nguyên tố thuộc nhóm 18 trên bảng tuần hoàn. Sở dĩ những nguyên tố này được gọi là khí hiếm hay khí trơ là vì chúng không tham gia vào bất kỳ phản ứng hóa học nào. Tuy nhiên, trên thực tế, các nhà khoa học vẫn chưa chắc chắn rằng nguyên tố có số nguyên tử 118 có tên Oganesson có thể không phải là khí hiếm.
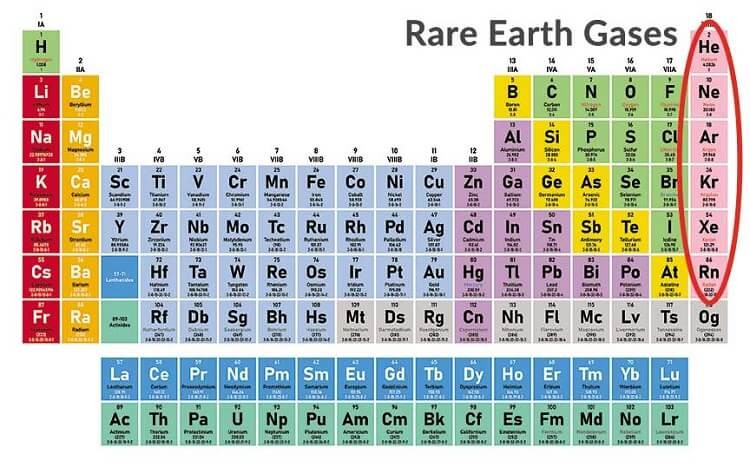
Vị trí của nhóm khí hiếm trong bảng tuần hoàn
2. Nhóm khí hiếm gồm những chất nào?
Khi nhìn vào bảng tuần hoàn chúng ta sẽ thấy các nguyên tố thuộc nhóm khí hiếm được sắp xếp từ trên xuống dưới gồm: Helium, Neon, Argon, Krypton, Xeon, Radon và Organeson (có thể không).
Cũng vì mức độ hoạt động hóa học thấp nên khí hiếm được các nhà khoa học phát hiện ra khá muộn. Mãi đến năm 1868, khí Helium mới được phát hiện trong quang phổ mặt trời. Tiếp theo, khí Neon được phát hiện vào năm 1898, Argon – 1894, Krypton, Xenon – 1898, Radon – 1900 và Organeson – 2006.
3. Đặc điểm của khí hiếm là gì?
Để tìm hiểu về tính chất của khí hiếm cũng như giải thích tại sao khí hiếm không có phản ứng hóa học nào, trước hết chúng ta cùng xem cấu hình electron của các nguyên tố khí hiếm trong bảng dưới đây:
|
Tên phần tử |
Ký hiệu hóa học |
số nguyên tử |
Cấu hình e |
Nhiệt độ sôi (°C) |
Nhiệt độ nóng chảy (°C) |
|
Heli |
hê hê |
2 |
1s2 |
−268,83 |
–272,00 |
|
neon |
Ne |
10 |
1s22s22p6 |
−245,92 |
−248,52 |
|
Argon |
Ar |
18 |
[Ne]3s23p6 |
−185,81 |
−189,60 |
|
Krypton |
Kr |
36 |
[Ar]3d104s24p6 |
−151,70 |
−157,00 |
|
xenon |
Xe hơi |
54 |
[Kr]4d105s25p6 |
−106,60 |
−111,50 |
|
radon |
Rn |
86 |
[Xe]4f145d106s26p6 |
−62,00 |
−71,00 |
Từ cấu hình electron, chúng ta thấy lớp vỏ ngoài cùng của tất cả các nguyên tố có 8 electron, ngoại trừ Helium có 2 electron. Khí hiếm không có xu hướng nhận thêm hoặc mất bớt electron để tạo ra cấu hình ổn định với đủ 8 electron lớp ngoài nên chúng ta có thể hiểu tại sao chúng lại có khả năng phản ứng hóa học yếu như vậy. Tuy nhiên, trong những điều kiện đặc biệt, khí hiếm vẫn có thể phản ứng.
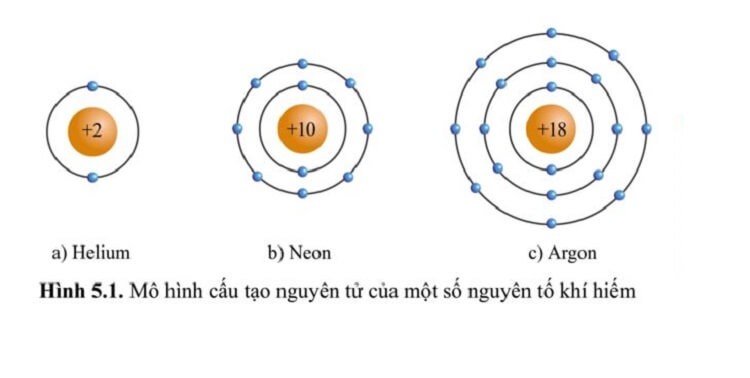
Mô hình cấu trúc vỏ của một số khí hiếm
Khí hiếm có tương tác nội phân tử cực kỳ yếu nên nhiệt độ sôi và nóng chảy của chúng đều thấp. Đồng thời, chênh lệch giữa hai mức nhiệt độ trên cũng nhỏ, không quá 10 độ C. Vì vậy, trong điều kiện bình thường, trạng thái tự nhiên của các nguyên tố này là ở trạng thái khí, thậm chí khối lượng nguyên tử của chúng có thể lớn hơn nhiều so với các chất rắn khác (ví dụ sắt – 56, đồng – 64).
– Radon được tạo ra trong chuỗi phân rã của Uranium.
– Helium tồn tại trong khí quyển, trong các mỏ khoáng sản chứa uranium, thorium…
– Neon, Argon, Krypton, Xenon đều có mặt trong bầu khí quyển Trái đất và được tách ra bằng quá trình hóa lỏng không khí và chưng cất phân đoạn.
4. Ứng dụng của khí hiếm trong đời sống sản xuất
Mặc dù các khí hiếm có tính trơ về mặt hóa học nhưng chúng đều có những ứng dụng quan trọng được sử dụng trong sản xuất và đời sống con người. Mỗi loại khí hiếm có những ứng dụng cụ thể khác nhau, cụ thể:
4.1 Ứng dụng của khí Heli
Helium là một loại khí nhẹ, chỉ nặng hơn hydro. Heli được sử dụng trong:
- Thổi bong bóng và sử dụng nhiên liệu để làm cho quả bóng bay lên không trung.
- Được tìm thấy trong bình oxy của thợ lặn sâu vì heli giúp ngăn ngừa độc tính của khí N2 và CO2 có thể tràn vào bình thở của thợ lặn.
- Helium hóa lỏng được sử dụng trong điều trị bệnh hen suyễn và các bệnh về đường hô hấp.
- Có khả năng thay đổi giọng nói.
- Dùng làm lớp bảo vệ trong hàn kim loại…

Khí heli giúp khinh khí cầu bay
4.2 Ứng dụng của đèn neon
- Vì khí Neon có màu đỏ cam nên được sử dụng trong các đèn lắp đặt trên bảng hiệu quảng cáo. Neon còn được dùng làm đèn báo điện áp cao.
- Cùng với Helium, Neon là loại khí được sử dụng để tạo ra tia laser khí.
- Neon lỏng là chất làm lạnh công nghiệp.
- Ngoài ra, Neon còn được ứng dụng làm cột thu lôi, ống đo bước sóng, ống âm cực trong tivi…

Neon trong ánh đèn của bảng hiệu quảng cáo
4.3 Ứng dụng của Argon
- Argon được sử dụng làm khí trong bóng đèn dây tóc vì ngay cả ở nhiệt độ cao nó vẫn ổn định và không phản ứng với dây tóc bóng đèn vonfram.
- Tạo môi trường khí trơ trong công nghệ hàn kim loại.
- Đóng vai trò là lớp phủ bảo vệ trong sản xuất titan và một số nguyên tố hóa học khác, trong sản xuất chất bán dẫn…
- Ngoài ra, Argon đang được nghiên cứu để sử dụng trong điều trị ung thư.
4.4 Ứng dụng của Krypton
Krypton được sử dụng để chế tạo tia laser krypton fluoride.
4.5 Ứng dụng của Xenon
- Giúp làm đèn flash xenon dùng trong đèn flash của máy ảnh.
- Là tác nhân oxy hóa trong hóa học phân tích, được sử dụng trong nghiên cứu tinh thể protein.
- Nó là một loại thuốc gây mê hoàn toàn trong y học, nhưng hiếm khi được sử dụng do giá thành cao.
- Xenon được sử dụng trong các ứng dụng năng lượng hạt nhân như sử dụng trong máy dò, buồng bong bóng hoặc các khu vực có yêu cầu đặc biệt.
Khí hiếm có nhiều ứng dụng quan trọng nhưng hiện nay do sử dụng quá mức nên nguồn khí hiếm đang dần cạn kiệt. Vì vậy chúng ta cần tiết kiệm và sử dụng khí hiếm một cách hợp lý.
Trên đây là những kiến thức chung về khí hiếm, các nguyên tố thuộc nhóm khí hiếm, đặc điểm và ứng dụng của chúng. Nếu độc giả có thắc mắc gì thêm, vui lòng liên hệ với chúng tôi qua website vietchem.com.vn hoặc đường dây nóng 0826 010 010.


Nội dung được phát triển bởi đội ngũ truongchuvananhue.edu.vn với mục đích chia sẻ và tăng trải nghiệm khách hàng. Mọi ý kiến đóng góp xin vui lòng liên hệ tổng đài chăm sóc: 1900 0000 hoặc email: hotro@truongchuvananhue.edu.vn