Nội dung bài viết
Oxy là nguyên tố phổ biến bao quanh chúng ta. Không có oxy chúng ta không thể thở và duy trì sự sống. Vậy tính chất vật lý và hóa học của oxy là gì? Ứng dụng của oxy trong đời sống và công nghiệp? Để tìm hiểu về vấn đề này chúng ta cùng nhau tìm hiểu qua bài viết dưới đây nhé.
1. Ôxi là gì?
Oxy là nguyên tố hóa học nhóm VIa, ký hiệu O trong bảng tuần hoàn và có trọng lượng nguyên tử 15,9994.
Nó là nguyên tố dồi dào nhất trên Trái đất, chiếm 20,9% bầu khí quyển, 45% vỏ Trái đất (dưới dạng khoáng chất oxit) và cũng chiếm gần như toàn bộ khối lượng nước của Trái đất (89%). Trong vũ trụ, nó phổ biến thứ ba, sau hydro và heli.
Oxy được tìm thấy với số lượng lớn trong các khoáng chất tự nhiên bao gồm sunfat, phốt phát, cacbonat và oxit. Trong tự nhiên, oxy tồn tại ở dạng phân tử O2 gọi là khí oxy. Cấu trúc Lewis của oxy được thể hiện bằng hai liên kết đôi giữa hai nguyên tử oxy. Nó có độ âm điện và có tính phản ứng cao do các cặp electron đơn độc có trên cả hai nguyên tử oxy.
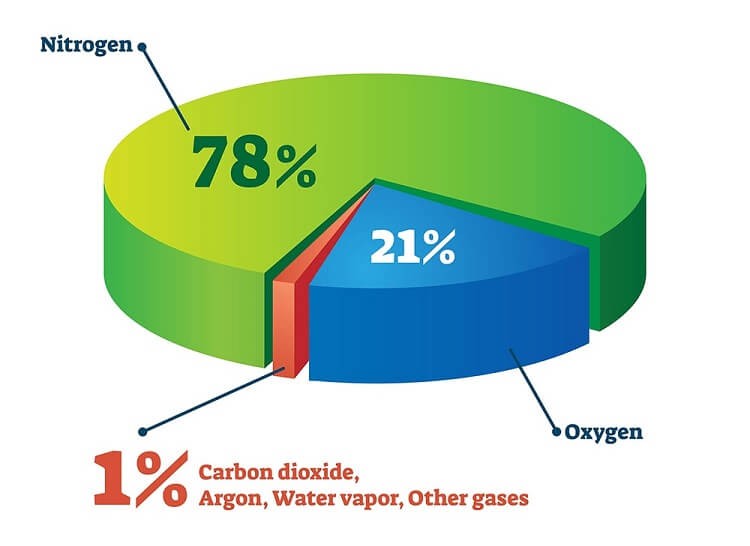
Oxy chiếm 21% trong không khí
2. Đồng vị của oxy
Dạng đẳng hướng phổ biến nhất của oxy nguyên tố là dioxygen (O2).
Dạng thù hình chính tiếp theo là Trioxygen (O3) thường được gọi là ozone. Ozone được tạo ra ở tầng trên của khí quyển khi O2 kết hợp với oxy nguyên tử được tạo ra bằng cách tách O2 bằng bức xạ cực tím UV.
3. Tính chất của oxy
Tính chất của oxi như sau:
3.1. Tính chất vật lý
- Oxy tồn tại ở cả ba dạng: lỏng, rắn và khí. Dạng lỏng và rắn có màu xanh nhạt. Oxy là một loại khí thông thường, là loại khí không màu, không mùi, không vị rất cần thiết cho cơ thể sống.
- Độ hòa tan: Oxy dễ dàng hòa tan trong nước lạnh. (30 cm 3 trên 1 lít nước hòa tan) ở 20 độ C. Oxy lỏng có tính thuận từ mạnh.
- Oxy chuyển từ thể khí sang thể lỏng ở nhiệt độ 182,96 độ C, sau đó có thể đông đặc hoặc đông lạnh ở -218,4 độ C.
3.2. Tính chất hóa học
Oxy có tính phản ứng và sẽ tạo thành oxit với tất cả các nguyên tố khác ngoại trừ heli, neon, argon và krypton.
- Phản ứng với phi kim:
Oxy phản ứng với C tạo thành CO2: C + 02 –> CO2
Oxy phản ứng với S tạo thành SO2: S + 02 –> SO2
- Phản ứng với kim loại:
Oxy phản ứng với sắt tạo thành oxit sắt (tạo thành rỉ sét). Tùy theo điều kiện giàu oxy mà tạo ra FeO, Fe2O3, Fe3O4…
- Phản ứng cháy:
Nó tham gia vào phản ứng cháy của hầu hết các chất như CH4, CO, C2H5OH…
CH4 + 2O2 –> CO2 + 2H2O
4. Điều chế oxy như thế nào?
Có nhiều cách điều chế oxy, nhưng tùy theo điều kiện mà có thể thực hiện bằng các phương pháp khác nhau như sau:
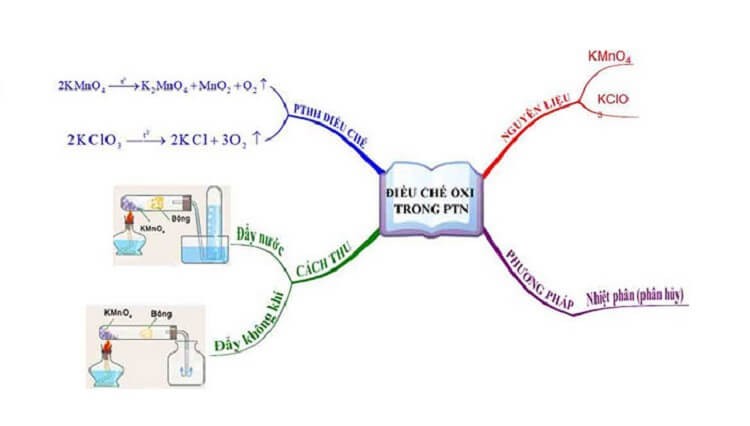
Chuẩn bị khí oxy trong phòng thí nghiệm
4.1. Trong phòng thí nghiệm
Các muối giàu oxy như nitrat, clorat và thuốc tím giải phóng oxy khi phân hủy nhiệt. Chất xúc tác MnO2 được sử dụng để tăng tốc độ phân hủy natri và kali clorat.
4.2. Trong công nghiệp
Có hai phương pháp sản xuất oxy trong công nghiệp:
- Chưng cất phần không khí hóa lỏng: Nitơ chiếm 78% trong không khí, có nhiệt độ sôi thấp hơn nên sẽ sôi trước, để lại oxy nguyên chất. Nhiệt độ sôi của oxy và nitơ là: -183 độ C, -196 độ C. Sau khi loại bỏ bụi và các hạt rắn khác, không khí được lọc được làm mát đến –200°C (không khí hóa lỏng). Sau đó nó được đưa vào dưới cùng của cột phân đoạn. Đầu tiên hơi nước ngưng tụ và được loại bỏ bằng bộ lọc hấp thụ. Đầu tiên, nitơ hóa lỏng ở -196 o C và được tách ra khỏi không khí. Sau đó, oxy hóa lỏng ở -183 độ C và được chiết xuất.
- Hấp thụ: Cho không khí đi qua sàng phân tử zeolite để hấp thụ nitơ và ta thu được oxy nguyên chất 90-93%.
5. Vai trò của oxy đối với đời sống con người
Mọi người đều cần oxy để thở. Oxy được động vật và con người hấp thụ và chuyển hóa thành carbon dioxide. Đối với thực vật, chúng sử dụng carbon dioxide và chuyển hóa nó thành oxy để thải vào khí quyển.
Thành phần sinh học bao gồm DNA, các hợp chất sinh học… trong cơ thể con người được tạo thành từ oxy. Vì vậy, oxy rất cần thiết cho mọi sinh vật.
Tuy nhiên, có quá nhiều oxy cũng không tốt. Nếu một người tiếp xúc với lượng lớn oxy trong thời gian dài, nó có thể gây tổn thương phổi. Những người làm việc thường xuyên hoặc tiếp xúc nhiều với oxy nguyên chất nên thực hiện xét nghiệm chức năng phổi trước khi bắt đầu làm việc và sau khi kết thúc công việc.

Ứng dụng của khí oxy
6. Ứng dụng của oxy trong cuộc sống
Một số ứng dụng chính của oxy trong đời sống và công nghiệp bao gồm:
– Dùng trong đèn khò oxy-axetylen để cắt và hàn kim loại.
– Dùng để loại bỏ tạp chất cacbon có trong thép trong quá trình sản xuất thép
– Hỗn hợp oxy lỏng và than bột được sử dụng làm chất nổ.
– Là chất oxy hóa cho nhiên liệu tên lửa.
– Trong công nghiệp, oxy được sử dụng với số lượng lớn để tổng hợp ethylene oxit, metanol và amoniac.
Trên đây là những thông tin cơ bản về oxy. Mời bạn tham khảo thêm các bài viết khác trên website vietchem.com.vn của chúng tôi để có thêm những kiến thức bổ ích về hóa học.


Nội dung được phát triển bởi đội ngũ truongchuvananhue.edu.vn với mục đích chia sẻ và tăng trải nghiệm khách hàng. Mọi ý kiến đóng góp xin vui lòng liên hệ tổng đài chăm sóc: 1900 0000 hoặc email: hotro@truongchuvananhue.edu.vn