Nội dung bài viết
Liên kết cộng hóa trị là gì? Đây là một trong những liên kết hóa học cơ bản phổ biến nhất. Vậy bạn biết gì về họ? Bài viết dưới đây sẽ giúp bạn có thêm thông tin chi tiết về khái niệm, phân loại và tính chất của nó.
Liên kết cộng hóa trị là gì?
Liên kết cộng hóa trị (LKCHT) được hiểu là liên kết giữa hai nguyên tử hoặc ion trong đó các cặp electron (e) sẽ dùng chung với nhau. Nó còn được gọi là liên kết phân tử, được hình thành giữa hai nguyên tử phi kim có giá trị độ âm điện tương tự hoặc tương đối gần nhau.
Chúng được tìm thấy trong nhiều loại hóa học, ví dụ như các gốc tự do và đại phân tử. Thuật ngữ này được sử dụng lần đầu tiên vào năm 1939, mặc dù vào năm 1919 Irving Langmuir đã đưa ra khái niệm “cộng hóa trị” để mô tả lượng electron được chia sẻ giữa các nguyên tử lân cận.
Các hợp chất có LKCHT có thể ở trạng thái khí, lỏng hoặc rắn. Mỗi cặp electron dùng chung giữa hai nguyên tử được gọi là cặp liên kết, nếu không nó được gọi là cặp đơn độc.
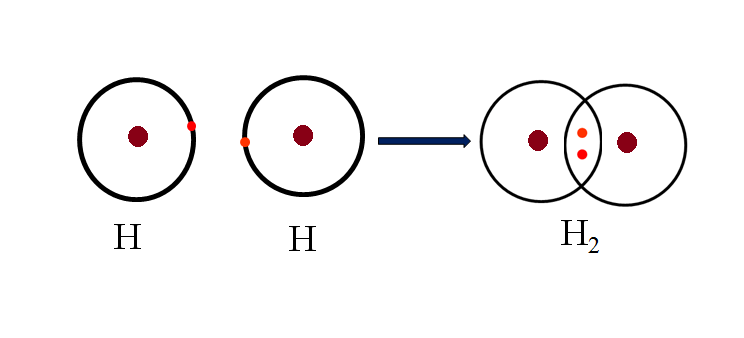
Liên kết cộng hóa trị là gì?
>>>XEM THÊM: Công thức hóa học của giấm là gì? Hướng dẫn cách làm đơn giản tại nhà
Công thức hóa học của giấm là gì? Hướng dẫn cách làm đơn giản tại nhà
Có bao nhiêu loại liên kết cộng hóa trị?
1. Liên kết cộng hóa trị có cực
- Liên kết được hình thành khi các electron dùng chung giữa các nguyên tử không được chia đều. Điều này chỉ xảy ra trong trường hợp một phía của nguyên tử có độ âm điện lớn hơn phía nó đang chia sẻ (sẽ có lực hút mạnh hơn các electron). Do đó, nó dẫn đến sự chia sẻ electron không đồng đều.
- Đặc điểm nổi bật: phân tử sẽ nghiêng về phía chứa các nguyên tử có độ âm điện thấp hơn, còn phía hơi âm chứa các nguyên tử có độ âm điện cao hơn.
- Do liên kết này, hợp chất cộng hóa trị được hình thành sẽ có thế năng tĩnh điện.
2. Liên kết cộng hóa trị không phân cực
- Nó được tạo ra khi các nguyên tử chia sẻ electron như nhau. Điều này thường xảy ra với hai nguyên tử có lực tương tự hoặc cùng điện từ. Đặc biệt, giá trị lực điện tử của chúng càng gần thì lực hút càng mạnh.
- Điều tương tự cũng xảy ra trong các phân tử khí, còn được gọi là diatomic. Các hạt có độ âm điện cao hơn sẽ kéo các electron ra khỏi phía yếu hơn.
3. Liên kết đơn phân tử
- Nó xảy ra khi hai phân tử có chung một cặp electron. Mặc dù dạng này yếu hơn và kém đậm đặc hơn so với liên kết đôi và liên kết ba nhưng nó ổn định nhất do khả năng phản ứng thấp, nghĩa là việc mất electron sẽ ít bị ảnh hưởng hơn.
4. Liên kết đôi phân tử
- Gọi hiện tượng hai nguyên tử dùng chung hai cặp electron với nhau. Nó được mô tả bằng hai đường ngang giữa hai nguyên tử trong cùng một phân tử. Loại này mạnh hơn liên kết đơn nhưng kém ổn định hơn.
5. Liên kết ba phân tử
- Liên kết cộng hóa trị kém ổn định nhất, xảy ra khi ba cặp electron được chia sẻ giữa hai nguyên tử trong phân tử.
Tính chất của các chất có liên kết cộng hóa trị
- Những chất mà phân tử của nó chỉ có loại liên kết này có thể là chất rắn như đường, sắt, lưu huỳnh,… hoặc chất lỏng như rượu, nước,… hoặc chất khí như clo, cacbonic, hydro,…. chỉ có loại trái phiếu này. LKCHT thường có điểm nóng chảy và sôi tương đối thấp, entanpi hóa hơi và nhiệt hạch thấp hơn.
- Các chất phân cực như đường, rượu etylic… sẽ tan trong dung môi phân cực như nước. Hầu hết các chất không phân cực như ion, v.v. đều hòa tan trong dung môi không phân cực như carbon tetrachloride, benzen, v.v..
Một số tính chất của liên kết phân tử:
- LKCHT không dẫn tới việc hình thành các email mới mà chỉ có thể trao đổi với nhau
- Đây là những liên kết hóa học rất mạnh tồn tại giữa nhiều nguyên tử
- Thường chứa khoảng 80 kilocalories/mol (kcal/mol) mỗi liên kết
- Một khi đã hình thành, nó rất hiếm khi bị phân hủy một cách tự nhiên

Tính chất của các chất có liên kết cộng hóa trị là gì?
Phân biệt liên kết cộng hóa trị và liên kết ion
|
Liên kết cộng hóa trị |
Liên kết ion |
|
Được hình thành giữa hai phi kim loại có độ âm điện giống nhau |
Được hình thành giữa một nguyên tố kim loại và một nguyên tố phi kim |
|
Có hình dạng nhất định |
Hình dạng không cố định |
|
Điểm nóng chảy và điểm sôi thấp |
Điểm nóng chảy và điểm sôi cao |
|
Độ phân cực thấp và dễ cháy |
Độ phân cực cao và khó cháy |
|
Trạng thái lỏng hoặc khí ở nhiệt độ phòng |
Trạng thái rắn ở nhiệt độ phòng |
|
Ví dụ: axit clohydric (HCl), metan (CH4) |
Ví dụ: axit sunfuric (H2SO4), natri clorua (NaCl) |
Sự khác biệt giữa liên kết cộng hóa trị và liên kết ion
Một số bài tập áp dụng liên kết cộng hóa trị
Ghi chú:
Cách tìm loại liên kết
- Xác định độ chênh lệch độ âm điện x
- Sau đó so sánh:
x < 0.4 => LKCHT không phân cực
0,4 x < 1.7 => Phân cực LKCHT
x ≥ 1,7 +> liên kết ion

Một số bài tập liên quan đến liên kết phân tử
Câu 1: Hợp chất nào sau đây có cả liên kết cộng hóa trị có cực và không cực?
1. NH4Br
2. H2O2
3. CH4
4. HF
Giải pháp:
Đáp án đúng: B
- Vì H2O2 có độ âm điện giữa O và H là 1,4 -> liên kết OH phân cực
- Hiệu độ âm điện giữa O và O là 0 -> liên kết OO không phân cực
Câu 2: Hợp chất nào sau đây chứa cả liên kết cộng hóa trị và liên kết ion?
1. NaOH
2. NaBr
3. NaNC
4. NaCN
Giải pháp:
Đáp án: C
- Liên kết cộng hóa trị giữa các nguyên tử N và C và liên kết ion giữa Na+ + – NC
Bài tập 3: Liên kết cộng hóa trị có tính chất:
1. Lực hút tĩnh điện giữa các ion mang điện tích trái dấu
2. Các cặp electron dùng chung giữa các nguyên tử
3. Lực tương tác giữa các phân tử
4. Lực tương tác giữa các nguyên tử
Giải pháp:
Đáp án: B
Bài tập 4: Gọi độ âm điện của oxi và hydro lần lượt là 3,44 và 2,20. Vậy liên kết hóa học trong phân tử H2O là:
1. ion
2. Cộng hóa trị không phân cực
3. Cộng hóa trị có cực
4. Tất cả các đáp án trên đều sai
Giải pháp:
- Ta có độ chênh lệch độ âm điện là: 3,44 – 2,20 = 1,24
- Vì 0,4 < 1,24 < 1.27 => liên kết cộng hóa trị có cực
Đáp án đúng: C
Bài 5: Độ âm điện của nhôm là 1,61 và của lưu huỳnh là 2,58. Vậy liên kết hóa học trong phân tử Al2S3 là:
1. Liên kết ion
2. LKCHT không bị phân cực
3. LKCHT phân cực
4. Không phải 3 đáp án trên
Giải pháp:
- Xét hiệu độ âm điện: 2,58 – 1,61 = 0,97
- Ta thấy: 0,4 < 0,97 < 1,7
=> Link trên là link phân cực LKCHT. Đáp án C
Trên đây là những thông tin giải đáp câu hỏi liên kết cộng hóa trị là gì, tính chất của nó và một số bài tập ứng dụng cơ bản. Hy vọng bài viết này đã giúp bạn hiểu rõ hơn về vấn đề này. Nếu có thắc mắc cần giải đáp, vui lòng liên hệ tới hotline 0826 010 010 hoặc nhắn tin qua website vietchem.com.vn để được tư vấn trực tiếp.


Nội dung được phát triển bởi đội ngũ truongchuvananhue.edu.vn với mục đích chia sẻ và tăng trải nghiệm khách hàng. Mọi ý kiến đóng góp xin vui lòng liên hệ tổng đài chăm sóc: 1900 0000 hoặc email: hotro@truongchuvananhue.edu.vn