Nội dung bài viết
Năng lượng ion hóa là một trạng thái năng lượng nhất định và hình thành nhiều dạng phân chia khác nhau. Điều này giúp tạo ra các dạng năng lượng đa dạng trong cuộc sống. Hãy cùng Trường Chu Văn An tìm hiểu ngay về dạng năng lượng này trong hóa học khi bạn quan tâm đến chủ đề này nhé.
1. Năng lượng ion hóa là gì?
Năng lượng ion hóa có thể được hiểu là năng lượng cần thiết để loại bỏ các electron khỏi nguyên tử đó ở trạng thái cơ bản. Dạng năng lượng này được ký hiệu là I, đơn vị là KJ/mol. Năng lượng ion này được chia thành nhiều loại và được gọi theo thứ tự xuất hiện như năng lượng ion hóa thứ nhất, thứ hai, thứ ba,…

Năng lượng ion hóa là năng lượng cần thiết để loại bỏ các electron khỏi một nguyên tử nhất định
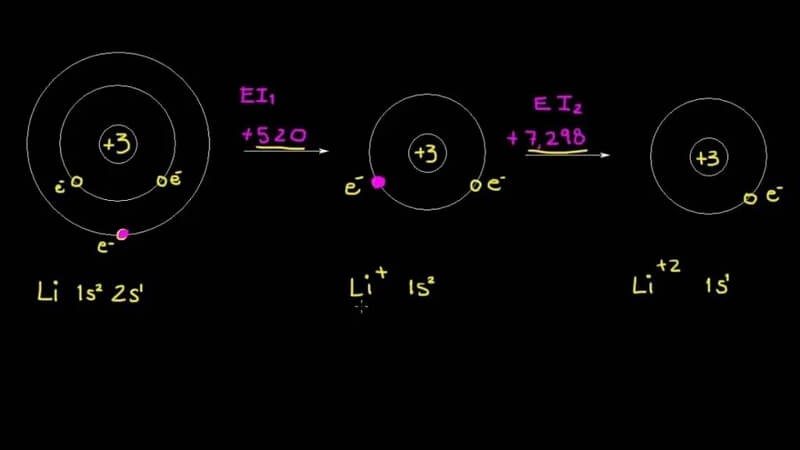
Năng lượng ion hóa đầu tiên là gì? Đây là dạng năng lượng cần thiết để tách electron đầu tiên ra khỏi nguyên tử, ký hiệu là I1. Tiếp theo, năng lượng ion hóa thứ 2 (I2) và thứ 3 (I3) là dạng năng lượng cần thiết để tách electron thứ 2 và thứ 3 ra khỏi các ion tương ứng và giá trị của chúng lớn hơn I1.
Ví dụ: Na → Na+ + e. Để có thể tách 1 mol electron ra khỏi 1 mol nguyên tử natri cần 497 KJ.mol năng lượng. Vì vậy ta nói năng lượng ion hóa thứ nhất của Na là 497 KJ/mol/
2. Bản chất của năng lượng ion hóa là gì?
Dạng năng lượng này có những tính chất rất đặc trưng của nguyên tử. Nếu electron ở gần hạt nhân hơn thì năng lượng ion hóa càng lớn. Ngược lại, electron càng ở xa hạt nhân thì năng lượng ion càng nhỏ. Với tính chất này, ta sẽ so sánh năng lượng ion hóa như sau: I1
Càng ở xa hạt nhân thì độ ion hóa càng nhỏ
3. Năng lượng ion hóa trong bảng tuần hoàn
Sự ion hóa xảy ra dựa trên bán kính nguyên tử, ái lực điện tử, độ âm điện và tính kim loại. Quá trình ion hóa này luôn tuân theo các xu hướng sau:
3.1. Xu hướng tăng dần khi di chuyển từ trái sang phải của electron
Trong chu kỳ của một nguyên tố hoặc dãy nguyên tố hóa học, năng lượng I sẽ luôn có xu hướng tăng dần. Vì bán kính nguyên tử giảm dần khi chuyển động theo chu kỳ. Điều này sẽ làm cho lực hút hiệu dụng lớn hơn, tạo ra liên kết giữa các electron âm và hạt nhân tích điện dương.
Sự ion hóa có giá trị nhỏ nhất khi chúng được gắn vào các hạt kim loại kiềm ở phía bên trái của bảng tuần hoàn. Chúng đạt cực đại khi liên kết với các khí cao quý ngoài cùng bên phải của bảng tuần hoàn. Khí quý có lớp vỏ hóa trị được lấp đầy giúp chống lại sự phân tách electron.
3.2. Xu hướng giảm dần khi di chuyển từ trên xuống dưới
Năng lượng ion hóa sẽ có xu hướng giảm khi di chuyển từ trên xuống dưới. Xu hướng này là sự xuất hiện thường xuyên của năng lượng ion và sẽ luôn có sự giảm dần từ trên xuống dưới của nhóm nguyên tố dọc theo cột. Chúng xảy ra do số lượng tử của electron ngoài cùng tăng theo quy luật.
Trong quá trình chuyển động, nguyên tử liên tục được bổ sung proton từ một nhóm điện tích dương. Chúng tác động lên lớp vỏ electron để làm cho nó nhỏ hơn và lọc electron khỏi lực hấp dẫn hạt nhân. Việc bổ sung thêm nhiều lớp vỏ electron di chuyển xuống nhóm sẽ đẩy các phân tử này ra xa hạt nhân hơn.
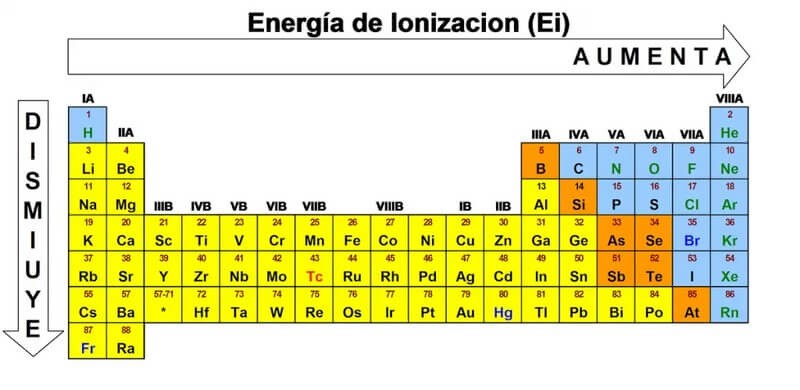
Xu hướng thay đổi năng lượng ion hóa trong bảng tuần hoàn
3.3. Năng lượng ion hóa có thể được chia thành các năng lượng khác nhau
Một xu hướng khác của I là nó có thể được chia thành các năng lượng khác nhau, bao gồm I1, I2, I3 và các ion hóa tiếp theo. Trong năng lượng ion hóa đầu tiên sẽ được sử dụng để loại bỏ electron hóa trị ngoài cùng khỏi nguyên tử trung tính. Năng lượng I2 tiếp tục loại bỏ các phân tử tiếp theo và In tiếp theo cũng thực hiện nhiệm vụ này. Quá trình đó tiếp tục cho đến khi đạt đến hạt nhân nguyên tử.
4. Làm thế nào để xác định năng lượng ion hóa?
Để xác định năng lượng ion hóa, các phương pháp cụ thể chính sau đây thường được sử dụng:
- Sử dụng phương pháp chính là quang hóa – Phương pháp này giúp xác định năng lượng ion do các electron phát ra nhờ hai hiệu ứng là quang điện và quang phổ nguyên tử.
- Phương pháp quang phổ điện tử tia cực tím, viết tắt UPS. Phương pháp này sử dụng kích thích nguyên tử và phân tử dựa trên bức xạ cực tím. Năng lượng của electron sau đó liên kết với hạt nhân nguyên tử để thực hiện các phép đo ion hóa dễ dàng hơn.
- Phương pháp quang phổ sao chép quang điện tử tia X. Phương pháp này vẫn áp dụng nguyên lý kích thích cũ của electron ngoài cùng để nghiên cứu sự khác biệt về các loại bức xạ được tạo ra.
Việc xác định năng lượng ion hóa xảy ra nhanh hay chậm phụ thuộc phần lớn vào loại máy móc được sử dụng. Nó cũng phụ thuộc vào tốc độ các electron được đẩy ra và độ phân giải thu được.
Xác định năng lượng ion hóa chủ yếu bằng phương pháp quang phát
Hiểu năng lượng ion hóa sẽ giúp ích cho nghiên cứu nguyên tử để ứng dụng vào các ứng dụng hóa học và công nghiệp. Hy vọng bài viết này hữu ích cho bạn đọc khi tìm hiểu. Xem thêm các chủ đề liên quan, quý độc giả vui lòng đồng hành cùng Trường Chu Văn An trong các bài viết tiếp theo.


Nội dung được phát triển bởi đội ngũ truongchuvananhue.edu.vn với mục đích chia sẻ và tăng trải nghiệm khách hàng. Mọi ý kiến đóng góp xin vui lòng liên hệ tổng đài chăm sóc: 1900 0000 hoặc email: hotro@truongchuvananhue.edu.vn