Nội dung bài viết
Axit cacboxylic là một hợp chất hữu cơ được tìm thấy nhiều trong tự nhiên, chẳng hạn như axit axetic trong giấm hay axit xitric trong chanh… Vậy cấu tạo của nó như thế nào? Tính chất hóa học và tính chất vật lý? Ứng dụng trong cuộc sống? Hãy cùng nhau tìm hiểu qua bài viết dưới đây nhé!
1. Axit cacboxylic là gì?
Axit cacboxylic là các hợp chất hữu cơ trong đó nguyên tử carbon (C) liên kết với nguyên tử oxy (O) bằng liên kết đôi và với nhóm hydroxyl (-OH) bằng liên kết đơn.
Công thức chung của axit cacboxylic là R−COOH hoặc R−CO2H, trong đó R có thể là alkyl, alkenyl, aryl hoặc nhóm khác.
2. Danh pháp axit cacboxylic
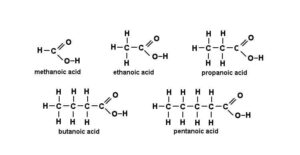
Axit cacboxylic thường được xác định bằng tên phổ biến. Họ thường có hậu tố -ic. Ví dụ, axit butyric (C3H7COOH) là axit butanoic.
Các phân tử phức tạp chứa axit cacboxylic, cacboxyl có thể được coi là vị trí số một trong chuỗi gốc ngay cả khi có các nhóm thế khác như axit 3-chloropropanoic. Ngoài ra, nó có thể được đặt tên là nhóm thế “carboxy” hoặc “axit cacboxylic” trên cấu trúc gốc khác như 2-carboxyfuran.
Tuy nhiên, hầu hết các axit cacboxylic đơn giản đều có tên chung vì chúng được phân lập từ các nguồn sinh học. Ví dụ, CH3CH2CH2COOH là axit butyric, lần đầu tiên thu được từ bơ và được đặt tên theo từ butyrum trong tiếng Latin có nghĩa là “bơ”.
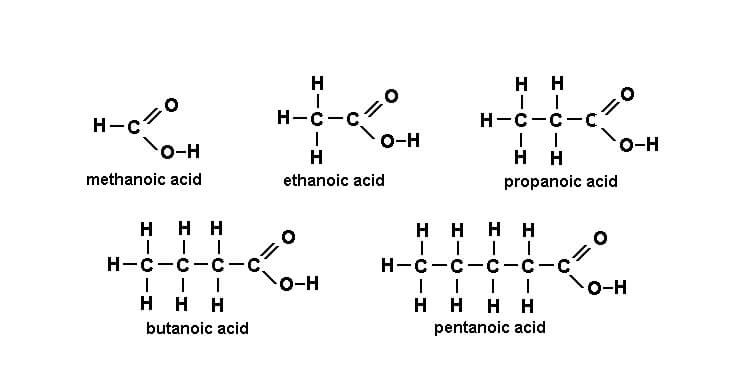
Tên một số axit cacboxylic
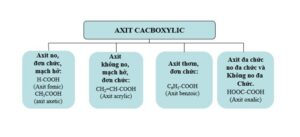
3. Phân loại axit cacboxylic
Dựa vào đặc điểm cấu trúc của gốc hydrocarbon, axit được chia thành:
- Axit cacboxylic bão hòa: Phân tử có gốc alkyl hoặc nguyên tử hydro liên kết với nhóm -COOH.
Ví dụ: HCOOH; CH3−COOH…
- Axit cacboxylic không bão hòa: Phân tử có gốc hydrocarbon không bão hòa, mạch hở gắn với nhóm -COOH.
Ví dụ: CH2=CH−COOH;CH3[CH2]7CH=CH[CH2]7COOH;…
- Axit cacboxylic thơm: Các phân tử có hydrocacbon thơm liên kết với nhóm -COOH.
Ví dụ: C6H5COOH,CH3−C6H4−COOH,…
Ngoài ra, axit cacboxylic còn được phân loại dựa vào số nhóm -COOH:
- Axit monocacboxylic: Trong phân tử có 1 nhóm – COOH. Ví dụ: HCOOH…
- Axit polycarboxylic: Trong phân tử có hai hoặc nhiều nhóm -COOH. Ví dụ: axit malonic HOOC−CH2−COOH…
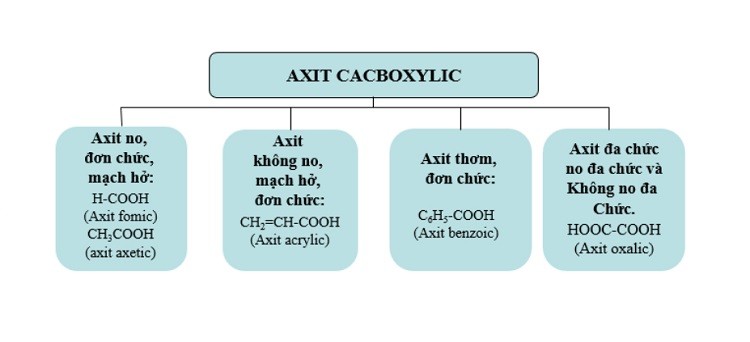
Phân loại axit cacboxylic
4. Tính chất của axit cacboxylic
Các tính chất vật lý và hóa học của axit cacboxylic như sau:
4.1. Tính chất vật lý
- Trạng thái tồn tại: Axit cacboxylic không phân nhánh (axit béo) ở dạng lỏng ở nhiệt độ phòng.
- Mùi: Các axit từ axit propanoic (C3) đến axit decanoic (C10) có mùi rất hôi, khó chịu.
- Độ hòa tan: Độ hòa tan của axit cacboxylic trong nước tương tự như độ hòa tan của rượu, aldehyd và xeton. Axit có ít hơn 5 nguyên tử cacbon hòa tan tốt trong nước. Các chất có trọng lượng phân tử cao hơn thường không hòa tan vì phần hydrocacbon lớn hơn có tính kỵ nước. Tuy nhiên, muối natri, amoni và kali của axit cacboxylic thường hòa tan tốt trong nước.
- Điểm sôi: Axit cacboxylic có điểm sôi cao hơn nhiều so với hydrocarbon, rượu, ete, aldehyd hoặc xeton có trọng lượng phân tử tương tự.
>>>XEM THÊM: Mua Amoni sunfat (NH4)2SO4, Nhật Bản, đóng gói 50kg/bao giá tốt.
Mua Amoni sunfat (NH4)2SO4, Nhật Bản, đóng gói 50kg/bao giá tốt.
4.2. Tính chất hóa học
– Tính chất hóa học chính của axit cacboxylic là tính axit. Chúng thường có tính axit mạnh hơn các hợp chất hữu cơ khác chứa nhóm hydroxyl nhưng thường yếu hơn các axit vô cơ quen thuộc (như axit clohydric HCl, axit sunfuric H2SO4…).
Axit cacboxylic thể hiện tính axit bằng cách phản ứng với bazơ để tạo thành muối cacboxylat, trong đó hydro của nhóm hydroxyl (–OH) được thay thế bằng cation kim loại.
CH3COOH + NaHCO3 → CH3COONa + CO2 + H2O
Ngoài ra, nó còn có thể phản ứng với các oxit bazơ, muối cacbonat…
– Một số phản ứng khác của axit cacboxylic là:
- Phản ứng este hóa: Đây là phản ứng thế nhóm -OH khi đun sôi axit cacboxylic với rượu (được xúc tác bởi H2SO4 đậm đặc) theo phản ứng sau:
R(COOH)x + R'(OH)t → Ry(COO)xyR'x + xyH2O (H2SO4, t0)
- Phản ứng tách nước
2RCOOH → (RCO)2O + H2O (P2O5)
- Phản ứng oxy hóa hoàn toàn
CxHyOz + (x + y/4 – z/2)O2 → xCO2 + y/2H2O
5. Cách nhận biết axit cacboxylic
Để nhận biết sự có mặt của loại axit này người ta sẽ dựa vào những đặc điểm đáng chú ý sau của nó:
- Có thể làm quỳ tím chuyển sang màu đỏ khi tiếp xúc
- Khi tác dụng với kim loại, axit cacboxylic sẽ giải phóng khí hydro
- Khi axit cacboxylic phản ứng với muối cacbonat hoặc hydro cacbonat, khí CO2 được giải phóng.
- HCOOH cũng có phản ứng hóa học tương tự như aldehyd. Nghĩa là có thể tạo kết tủa màu trắng khi phản ứng với muối AgNO3/NH3…
>>>XEM THÊM: Axit boric H3BO3 99%, Mỹ, 25kg/bao
Axit boric H3BO3 99%, Mỹ, 25kg/bao
6. Cách điều chế axit cacboxylic?
Hiện nay, axit này sẽ được điều chế theo các phương pháp sau:
- Oxy hóa rượu etylic bằng oxy trong không khí bằng giấm: CH3-CH2-OH + O2 → CH3COOH + H2O
- Tổng hợp axit cacboxylic từ nguyên liệu axetylen thông qua hai phản ứng hóa học sau:
1, Oxy hóa rượu: R-CH2-OH + O2 → R-CHO + H2O
2, Tiếp tục oxy hóa aldehyd thu được theo phản ứng sau: R-CHO + [O] → R-COOH
>>>XEM THÊM: Kali cacbonat K2CO3 99,5%, sản xuất tại Hàn Quốc, đóng gói 25kg/bao
Kali cacbonat K2CO3 99,5%, sản xuất tại Hàn Quốc, đóng gói 25kg/bao
7. Ứng dụng của axit cacboxylic trong đời sống
Axit cacboxylic có nhiều ứng dụng. Nhiều axit cacboxylic được sản xuất công nghiệp ở quy mô lớn. Este của axit béo là thành phần chính của lipid và polyamit của axit aminocarboxylic là thành phần chính của protein.
Mỗi loại axit được sử dụng trong các ngành công nghiệp khác nhau như sau:
– Axit formic là axit cacboxylic đơn giản nhất được sử dụng làm chất khử trùng, chất xử lý dệt may và làm chất khử axit.
– Axit citric được dùng làm chất tăng hương vị và chất bảo quản trong thực phẩm và đồ uống.
– Axit axetic được sử dụng rộng rãi trong sản xuất nhựa xenlulo và este. Ngoài ra còn giúp tạo vị chua cho giấm, giấm gia dụng chứa khoảng 5% axit axetic. Aspirin là một este của axit salicylic, một hoạt chất được sử dụng rộng rãi trong ngành dược phẩm được điều chế từ axit axetic.
– Axit propionic là chất bảo quản thực phẩm.
– Axit palmitic và axit stearic rất quan trọng trong sản xuất xà phòng, mỹ phẩm, dược phẩm, nến và lớp phủ bảo vệ. Ngoài ra, axit stearic còn được sử dụng trong cao su nhân tạo.
– Axit acrylic được dùng làm este trong sản xuất polyme.
– Axit metacrylic đóng vai trò là este và bị polyme hóa tạo thành Lucite.
– Axit oleic được sử dụng trong sản xuất xà phòng, chất tẩy rửa và dệt may.
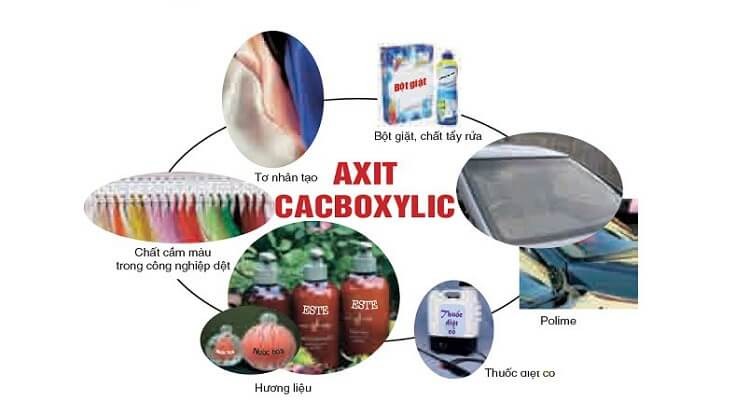
Ứng dụng của axit cacboxylic
8. Các câu hỏi thường gặp liên quan đến axit cacboxylic
8.1. Mùi của axit này có đặc điểm gì?
Axit này có mùi chua nồng, dễ nhận biết. Tuy nhiên, một este – một biến thể của axit này có mùi hương cực kỳ dễ chịu nên được dùng trong sản xuất nước hoa.
8.2. Đặc điểm nhận biết của axit cacboxylic là gì?
Quang phổ hồng ngoại thường được sử dụng để xác định axit trong các mẫu thử. Sự dao động của liên kết C=O trong chất này sẽ tạo ra đỉnh hấp thụ sắc nét ở số sóng trong khoảng từ 1680 đến 1725 cm−1. Nhờ đó mà việc nhận dạng trở nên dễ dàng hơn rất nhiều.
8.3. Axit cacboxylic tồn tại ở dạng nào?
Trong cuộc sống hàng ngày, axit cacboxylic tồn tại ở nhiều dạng khác nhau. Ví dụ cụ thể là trong các thành phần cơ bản của protein, trong giấm… Khi mất đi một proton H+, nhóm chức cacboxyl sẽ trở thành một anion quan trọng của cacboxylat.
Trên đây là những thông tin cơ bản về axit cacboxylic. Nếu có thắc mắc, bạn có thể liên hệ với chúng tôi qua hotline 0826 010 010 hoặc tham khảo thêm các bài viết trên vietchem.com.vn.


Nội dung được phát triển bởi đội ngũ truongchuvananhue.edu.vn với mục đích chia sẻ và tăng trải nghiệm khách hàng. Mọi ý kiến đóng góp xin vui lòng liên hệ tổng đài chăm sóc: 1900 0000 hoặc email: hotro@truongchuvananhue.edu.vn