Nội dung bài viết
Oxit axit là gì?? Tính chất hóa học của oxit axit trong hóa học lớp 8 là gì? Đây là câu hỏi được gửi về vietchem nhiều nhất trong các kỳ thi học kỳ và THPT gần đây. Hãy cùng chúng tôi tìm hiểu chi tiết về các oxit axit, tính chất và bài tập của chúng với lời giải chi tiết trong bài viết dưới đây.
1. Định nghĩa oxit axit là gì?
Oxit axit còn được gọi là axit anhydrit, đây là những oxit phản ứng với bazơ tạo thành muối hóa học và phản ứng với nước tạo thành axit. Oxit axit thường là phi kim loại và phản ứng với nước tạo ra sản phẩm axit tương ứng. Oxit axit bao gồm hai nguyên tố hóa học, một trong số đó sẽ là oxy.
Công thức chung là: MaOb.

Định nghĩa oxit axit là gì?
2. Cách gọi tên oxit axit

Cách đọc tên các oxit axit trong hóa học
Tên oxit axit: (Tên tiền tố chỉ số hiệu nguyên tử của phi kim) + Tên phi kim loại + (tên tiền tố chỉ số nguyên tử của oxy) + ''Oxide''
|
chỉ mục |
Tên tiền tố |
Ví dụ |
|
1 |
Mono (không cần đọc để biết các hợp chất thông thường) |
ZnO: Kẽm oxit |
|
2 |
Đi |
UO2: Uranium dioxide |
|
3 |
Trí |
SO3: Lưu huỳnh trioxit |
|
4 |
Tetra |
|
|
5 |
ngũ hành |
N2O5: Đinitơ pentoxit |
|
6 |
lục giác |
|
|
7 |
Hepa |
Mn2O7: Dimangan heptoxit |
3. Có những loại oxit nào?
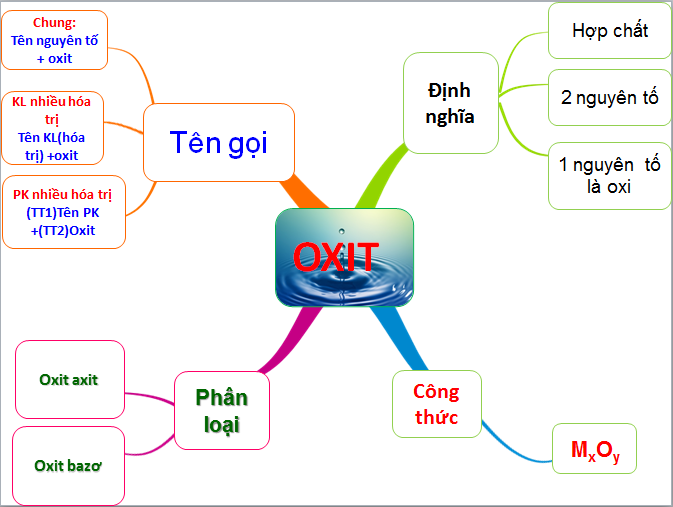
Phân loại oxit trong hóa học
3.1. Oxit cơ bản
Đây là những oxit phản ứng với axit tạo thành muối và nước. Một số oxit cơ bản phản ứng với nước tạo thành bazơ hòa tan gọi là kiềm.
- Ví dụ: Na2O – NaOH, Fe2O3 – Fe(OH)3…
3.2. oxit axit
Đây là những oxit phản ứng với bazơ để tạo ra muối và nước, phản ứng với nước tạo thành axit.
- Ví dụ: Mn2O7 – HMnO4, CO2 – H2CO3, P2O5 – H3PO4.
3.3. Oxit lưỡng tính
Oxit có thể phản ứng với axit hoặc bazơ tạo thành muối và nước.
- Ví dụ: Al2O3, ZnO.
3.4. Oxit trung tính
Đây là một oxit không phản ứng với nước tạo thành bazơ hoặc axit và không phản ứng với bazơ hoặc axit để tạo thành muối.
- Ví dụ: Carbon monoxide – CO, Nitrogen monoxide – NO,…
4. Tính chất hóa học của oxit axit
4.1. Oxit axit hòa tan
Ngoại trừ SiO2, hầu hết các oxit axit đều tan trong nước tạo thành dung dịch axit.
Ví dụ:
SO3 + H2O → H2SO4
P2O5 + 3H2O → 2H3PO4
N2O5 + H2O → 2HNO3
SO2 + H2O→ H2SO3
4.2. Axit oxit tác dụng với nước H2O
Hầu hết các loại oxit axit khi phản ứng với nước H2O sẽ tạo ra dung dịch axit trừ SiO2.
SO3 + H2O → H2SO4
CO2 + H2O→ H2CO3 (Phản ứng thuận nghịch)
4.3. Phản ứng với các oxit bazơ hòa tan tạo thành muối
Thông thường đây là những oxit phản ứng với nước (Na2O, CaO, K2O, BaO).
SO3 + CaO -> CaSO4
P2O5 + 3Na2O -> 2Na3PO4

Tính chất hóa học của oxit axit
4.4 Phản ứng với bazơ hòa tan
Bazơ hòa tan là bazơ của kim loại kiềm và kiềm thổ mới. Cụ thể có 4 bazơ hòa tan như sau: NaOH, Ca(OH)2, KOH, Ba(OH)2.
P2O5 + 6KOH → 2K3PO4 + 3H2O
Tùy theo tỉ lệ mol giữa oxit axit và bazơ tham gia phản ứng mà sản phẩm tạo ra sẽ khác nhau, có thể là nước + muối trung tính, muối axit hoặc hỗn hợp 2 muối.
- Gốc axit tương ứng có hóa trị II
Đối với kim loại thuộc bazơ có hóa trị I:
Tỉ lệ mol của bazơ và oxit axit là 1: Phản ứng tạo ra muối axit
NaOH + SO2→ NaHSO3
Tỉ lệ mol của bazơ và oxit axit là 2: Phản ứng tạo ra muối trung tính
2KOH + SO3 → K2SO3 +H2O
- Đối với kim loại ở bazơ, chúng có hóa trị II
Tỉ lệ mol của bazơ và oxit axit là 1: Phản ứng tạo ra muối trung tính
CO2 + Ca(OH)2 → CaCO3
Tỉ lệ mol của bazơ và oxit axit là 2: Phản ứng tạo ra muối axit
SiO2 + Ba(OH)2 → BaSiO3
- Đối với axit có gốc axit hóa trị ba
Đối với kim loại có hóa trị I:
Tỷ lệ mol của bazơ và axit oxit là 6:
P2O5 + 6NaOH → 2Na2HPO4 +H2O
Tỉ lệ mol của bazơ và axit oxit là 4:
P2O5 + 4NaOH → 2NaH2PO4 +H2O
Tỉ lệ mol của bazơ và axit oxit là 2:
P2O5 + 2NaOH +H2O → 2NaH2PO4
4.5. Oxit lưỡng tính
Oxit có khả năng phản ứng với axit hoặc bazơ tạo thành muối và nước.
Ví dụ: Al2O3, ZnO.
4.6. Oxit trung tính
Đây là một oxit không phản ứng với nước tạo thành bazơ hoặc axit và không phản ứng với bazơ hoặc axit để tạo thành muối.
Ví dụ: Carbon monoxide – CO, Nitrogen monoxide – NO,…
5. Các dạng bài tập oxit axit tác dụng với bazơ
5.1. Trường hợp 1
Khi oxit axit (CO2, SO2…) phản ứng với dung dịch kiềm (KOH, NaOH…)
Phương trình hóa học
CO2 + NaOH → NaHCO3 (1)
CO2 + 2NaOH → Na2CO3 + H2O (2)
Giải pháp
Bước 1: Xét tỉ lệ mol của bazơ và axit oxit, gọi T
– Nếu T ≤ 1: Sản phẩm thu được là muối axit, nghĩa là chỉ xảy ra phản ứng (1).
– Nếu 1 < T < 2: Sản phẩm thu được là muối axit và muối trung tính, nghĩa là hai phản ứng (1) và (2) xảy ra đồng thời.
– Nếu T ≥ 2: Sản phẩm thu được là muối trung tính nghĩa là chỉ xảy ra phản ứng (2).
Bước 2: Viết phương trình phản ứng và tính theo phương trình đó (nếu cả hai phản ứng xảy ra thì cần ẩn và giải theo hệ phương trình)
Bước 3: Tính toán theo yêu cầu của bài toán đã cho

Các dạng bài tập oxit axit thường gặp trong hóa học lớp 8
5.2. Trường hợp 2
Khi oxit axit (CO2, SO2…) phản ứng với dung dịch kiềm thổ (Ca(OH)2, Ba(OH)2…)
Phương trình phản ứng
CO2 + Ca(OH)2 → CaCO3 + H2O (1)
2CO2 + Ca(OH)2 → Ca(HCO3)2 (2)
Giải pháp
Bước 1: Xét tỷ lệ
– Nếu T ≤ 1: Sản phẩm thu được là muối trung tính (xảy ra phản ứng (1))
– Nếu 1 < T < 2: Sản phẩm thu được là muối axit và muối trung tính (xảy ra phản ứng (1) và (2))
– Nếu T ≥ 2: Sản phẩm thu được là muối axit (xảy ra phản ứng (2)).
Bước 2 và bước 3 tương tự như trường hợp 1.
6. Bài tập oxit axit bằng dung dịch
Bài tập hóa học có lời giải chi tiết
Bài 1: Tiến hành sục khí CO2 ở điều kiện tiêu chuẩn vào lượng dư dung dịch Ca(OH)2. Tính khối lượng kết tủa thu được sau phản ứng.
Giải pháp:
Theo bài toán ta tính được nCO2 = 5,6/22,4 = 0,25 mol
Ca(OH)2 dư nên ta có phương trình phản ứng sau:
CO2 + Ca(OH)2 → CaCO3↓ + H2O
0,25 → 0,25 → 0,25
Từ phương trình ta có n CaCO3 = 0,25 mol => m CaCO3 = 100 x 0,25 = 25 gam
Kết luận: Sau phản ứng thu được kết tủa có khối lượng 25 gam.
Bài 2: Dẫn 2,24 lít khí SO2 ở điều kiện tiêu chuẩn vào 150 ml dung dịch NaOH 1M. Tính nồng độ mol của các chất trong dung dịch sau phản ứng.
Giải pháp:
Theo bài toán ta có nSO2 = 2,24/22,4 = 0,1 mol, nNaOH = CM.V = 1 x 0,15 = 1,15 mol
Phương trình phản ứng
SO2 + 2NaOH → Na2SO3 + H2O (1)
0,1 0,15
0,075 0,15 0,075
Từ phương trình ta thấy SO2 dư nên số mol sẽ tính được theo NaOH
=> nNa2SO3 = 0,2 (mol)
CO2 + Na2SO3 + H2O → 2NaHSO3 (2)
0,025 0,075
0,025 0,025 0,05
Theo phương trình (2) ta thấy NaHSO3 dư nên sẽ tính theo số mol SO2
nNaHSO3 = 2nSO2 = 0,025,2 = 0,05 (mol) => m = 5,2 (gam)
NNa2SO3 dư = 0,075 – 0,025 = 0,05 (mol) => m = 6,3 (gam)
Bài 3: Đốt cháy hoàn toàn 8 gam lưu huỳnh. Sản phẩm khi tạo thành sẽ hấp phụ hoàn toàn vào 500 ml dung dịch Ba(OH)2 0,4M thu được kết tủa X và dung dịch Y. Khi đun nóng dung dịch Y ta thu được m gam kết tủa. Tính giá trị của m.
Giải pháp:
Theo bài toán ta tính được nS = 8/32 = 0,25 ml; nBa(OH)2 = 0,4 X 0,5 = 0,2 ml
S + O2 → SO2
0,25 0,25
SO2 + Ba(OH)2 → BaSO3↓ + H2O (1)
0,25 0,2
Theo phương trình (1) ta thấy SO2 dư là 0,05 mol => nBaSO3 = 0,2 (mol)
SO2 + BaSO3 + H2O → Ba(HSO3)2 (2)
0,05 0,2
Theo phương trình (2) ta thấy BaSO3 dư nên số mol sẽ tính theo SO2
Vậy ta có kết tủa Y nBaSO3 dư = 0,2 – 0,005 = 0,15 mol
Bài 4: Đun sôi 6,72 lít khí CO2 ở điều kiện tiêu chuẩn vào 400ml dung dịch NaOH 1M. Tính khối lượng muối tạo thành.
Phần thưởng
Ta có: nCO2 = 6,72 x 22,4 = 0,3 (mol)
nNaOH = CM x V = 1 x 0,4 = 0,4 (mol)
Phương trình hóa học
CO2 + 2NaOH → Na2CO3 + H2O (1)
Có: 0,3mol 0,4mol
P/ứ đọng: 0,2 <- 0.4 -> 0,2
Theo phương trình (1) ta thấy CO2 dư nên số mol tính theo NaOH nghĩa là nNa2CO3 = 0,2 (mol)
nCO2 p/dư = 0,2 (mol) => dư nCO2 = 0,3 – 0,2 = 0,1 (mol)
CO2 dư: CO2 + Na2CO3 + H2O → 2NaHCO3 (2)
Có: 0,1mol 0,2mol
P/trạng thái: : 0,1 -> 0,1 -> 0,2
Theo phương trình (2) ta thấy Na2CO3 dư nên số mol tính theo CO2:
nNaHCO3 = 2nCO2 = 0,1 x 2 = 0,2 (mol)
NNa2CO3 dư = 0,2 – 0,1 = 0,1 (mol)
Dung dịch thu được sau phản ứng gồm 2 muối: Na2CO3 (0,1 mol), NaHCO3 (0,2 mol)
mNa2CO3 = 0,1 x 106 = 10,6 (g)
mNaHCO3 = 0,2 x 84 = 16,8 (g)
Trên đây là những thông tin về oxit axit mà Hóa chất vietchem muốn chia sẻ đến bạn đọc. Hy vọng qua đó bạn đã biết axit oxit là gì? tên, tính chất hóa học và cách giải bài tập Axit oxit tác dụng với bazơ như thế nào?. Nếu bạn có bất kỳ thắc mắc nào về oxit, vui lòng liên hệ với chúng tôi bằng cách điền vào hộp thoại hỗ trợ trực tuyến 24/7 để được giải đáp tốt nhất.
>>>XEM THÊM:  : Silicon có độc không? Thông tin cần thiết về họ
: Silicon có độc không? Thông tin cần thiết về họ



Nội dung được phát triển bởi đội ngũ truongchuvananhue.edu.vn với mục đích chia sẻ và tăng trải nghiệm khách hàng. Mọi ý kiến đóng góp xin vui lòng liên hệ tổng đài chăm sóc: 1900 0000 hoặc email: hotro@truongchuvananhue.edu.vn