Nội dung bài viết
Việc áp dụng phương pháp cô đặc dung dịch không chỉ được thực hiện trong phòng thí nghiệm mà còn phổ biến ở nhiều lĩnh vực khác nhau. Vậy thảo mộc khô là gì? Làm thế nào để tập trung dung dịch hiệu quả và tối ưu? Hãy cùng Trường Chu Văn An tìm hiểu cụ thể vấn đề này qua chia sẻ dưới đây của Trường Chu Văn An nhé.
1. Thảo mộc khô là gì?
Bay hơi là phương pháp thường được sử dụng để tách bất kỳ chất rắn nào khỏi hỗn hợp hoặc dung dịch ban đầu. Phương pháp này đòi hỏi nhiệt độ khá cao để tách các chất rắn khó bay hơi và chất rắn khó hòa tan ra khỏi dung dịch.
Trong quá trình thực hiện, bạn có thể dùng bình cồn để đun nóng hoặc dùng phản ứng nhiệt phân để tạo thành dung dịch. Dung dịch này sau đó được làm bay hơi. Tuy nhiên, phải cẩn thận để tránh sai sót về tỷ lệ và sự cân bằng tối ưu của phản ứng. Ngược lại, chỉ một sai sót nhỏ cũng có thể gây nguy hiểm.
Ví dụ:
- Cô ấy đã hết dung dịch muối. Kết quả là muối khan.
- Làm bay hơi dung dịch HNO3. Tiến hành nhiệt phân dung dịch HNO3 thu được NO2 kết tủa. Phương trình phản ứng: 4HNO3 → 4NO2 + O2 + 2H2O.
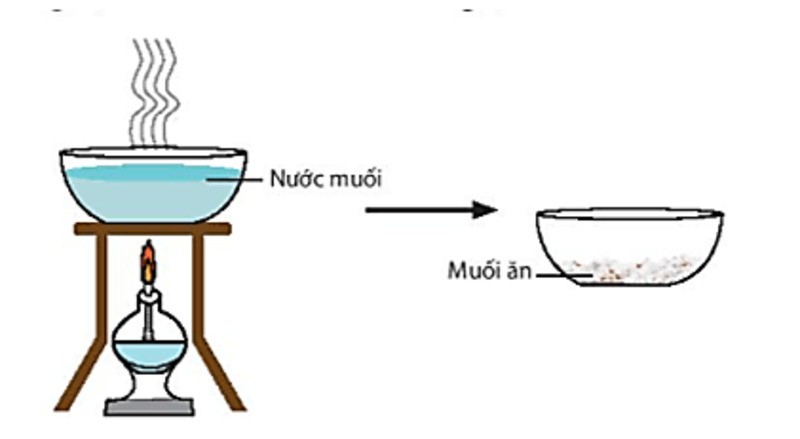
Làm bay hơi dung dịch muối thu được muối khan
2. Cách tiến hành phương pháp bay hơi
Bay hơi hóa học là phương pháp làm bay hơi các chất có nhiệt độ sôi thấp và thu được chất rắn. Quá trình từng bước diễn ra theo thứ tự sau:
2.1. Chuẩn bị dung dịch
Trước khi tiến hành cần chuẩn bị dung môi nước và dung dịch đậm đặc. Dung dịch này có thể là muối tan trong nước, dung dịch muối hoặc bất kỳ dung dịch hóa học nào.
Sau đó, cho dung dịch và dung môi vào tô hoặc nồi có đáy rộng. Điều này sẽ giúp cho quá trình bay hơi nước diễn ra thuận lợi, dễ dàng và tiết kiệm thời gian hơn.
2.2. Tiến hành đun nóng dung dịch
Đặt tô hoặc nồi chứa dung dịch cần bay hơi lên bếp. Đun sôi dung dịch vừa chuẩn bị. Khi đun nóng ở nhiệt độ cao, nước bên trong sẽ sôi và bay hơi. Chất cần tách sẽ đọng lại dưới đáy nồi.
2.3. Thu lấy chất cần tách
Sau khi đun sôi một thời gian, nước trong nồi sẽ cạn. Lúc này trong nồi chỉ còn chất cần tách. Bạn cần lấy ống hút hoặc xẻng để thu thập nó.
2.4. Lấy chất cần tách và sấy khô
Với chất cần tách vừa lấy được thì không nên đóng gói ngay. Để chúng ở nơi thoáng gió trong một khoảng thời gian nhất định để khô hoàn toàn. Sau đó, cất vào một mảnh giấy lọc để dễ dàng lấy ra khi cần.
3. Ứng dụng của cô ấy còn nông cạn so với thực tế
Dựa vào đặc điểm của phương pháp ngưng tụ có thể ứng dụng trong nhiều lĩnh vực khác nhau. Tiêu biểu:
- Dùng trong sản xuất muối sạch từ nước biển.
- Tách tinh dầu khỏi các thành phần tự nhiên.
- Dùng để tách các hợp chất hóa học ra khỏi hỗn hợp.
- Ứng dụng phương pháp bay hơi trong phòng thí nghiệm…
4. Bài tập ứng dụng
Thông qua những kiến thức về sự bay hơi của dung dịch đã được phân tích chi tiết ở phần trên, các bạn có thể áp dụng để trả lời một số bài tập dưới đây:
Bài 1: Lấy hỗn hợp kim loại hóa trị II Sau phản ứng thu được dung dịch mới và 8,96 lít khí H2 ở điều kiện tiêu chuẩn. Sau phản ứng thu được bao nhiêu gam muối khan từ dung dịch đậm đặc?
Hồi đáp
Gọi A và B lần lượt là khối lượng nguyên tử của hai kim loại X và Y mà bạn đang tìm kiếm. Gọi số mol của A là a, số mol của B là b. Vậy Aa + Bb = 7,8 gam.
Ta có số mol H2 thu được sau phản ứng là: 8,96/22,4 = 0,4 (mol)
Phương trình ngưng tụ là:
X +H2SO4 → XSO4 + H2
aaa mol
2Y + 3H2SO4 → Y2(SO4)3 + 3H2
b 1,5b 0,5b 1,5b mol
→ a + 1,5b = 0,4 → a = 0,4 – 1,5b (mol)
nH2SO4 = nH2 = 0,4 (mol) → mH2SO4 = 0,4 x 98 = 39,2 (gam)
Theo định luật bảo toàn khối lượng mX + mY + mH2SO4 = m muối khan + mH2
→ m muối khan = mX + mY – mH2 = 7,8 + 39,3 – 0,4 x 2 = 46,2 (gam)
Bài 2: Hoà tan hoàn toàn trong Axit HCl hỗn hợp 20 gam Fe và Mg thu được dung dịch X và 11,2 lít khí thoát ra. Nếu lấy dung dịch X cô đặc khô thì thu được bao nhiêu gam?
Hồi đáp
Phương trình phản ứng
Mg + 2HCl → MgCl2 + H2
Fe + 2HCl → FeCl2 + H2
Số mol của Hydro là: nH2 = 11,2/22,4 = 0,5 (mol)
→ nH2 = 1/2nHCl → nHCl = 0,5 x 2 = 1 (mol)
→mHCl = 1 x (35,5 +1) = 36,5 (gam)
Theo định luật bảo toàn khối lượng: m(Fe,Mg) + mHCl = msalt + mH2
→ m muối = m (Fe + Mg) + mHCl – mH2 = 20 – 36,5 – 0,5 x 2 = 55,5 gam
Vậy dung dịch sau khi ngưng tụ là 55,5 (gam)
Bài 3: Hoà tan hoàn toàn 5,6 gam Fe trong dung dịch HCl dư. Kết quả là khí thoát ra và dung dịch X. Cô đặc dung dịch X thu được muối khan. Vậy có bao nhiêu gam muối khan?
Hồi đáp
Phương trình phản ứng: Fe + 2HCl → FeCl2 + H2
Ta có: nFe = 5,6/56 = 0,1 mol → nFeCl2 = nH2 = nFe = 0,1 mol
→ mFeCl2 = 0,1 x (56 + 35,5×2) = 12,7 gam
Vậy số muối khan thu được sau phản ứng là 12,7 gam.
Cô quay là phương pháp mang lại nhiều lợi ích trong một số lĩnh vực nhất định như chiết xuất, kiểm nghiệm… Hy vọng những chia sẻ của Trường Chu Văn An sẽ giúp các bạn hiểu rõ hơn về phương pháp này và biết cách áp dụng vào thực tế. mạng sống.


Nội dung được phát triển bởi đội ngũ truongchuvananhue.edu.vn với mục đích chia sẻ và tăng trải nghiệm khách hàng. Mọi ý kiến đóng góp xin vui lòng liên hệ tổng đài chăm sóc: 1900 0000 hoặc email: hotro@truongchuvananhue.edu.vn