Nội dung bài viết
Amoniac lỏng là một hóa chất phổ biến trong tự nhiên và được sử dụng phổ biến trong ngành điện lạnh và công nghiệp hóa chất. Vậy dung dịch NH3 là gì? Chúng có những đặc tính nổi bật nào khiến chúng được sử dụng phổ biến đến vậy? Hãy cùng vietchem tìm hiểu về loại hóa chất này nhé!
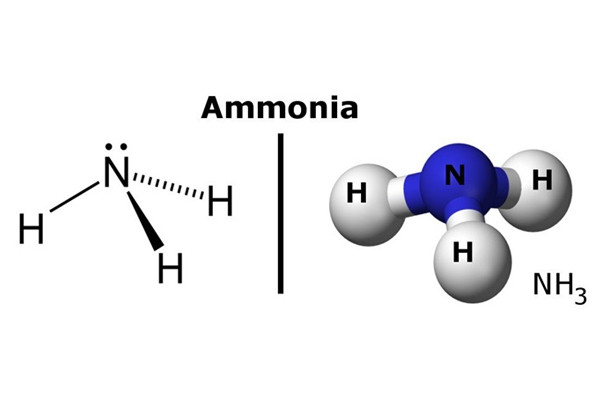
Amoniac lỏng là một hợp chất vô cơ có công thức hóa học NH3
I. Amoniac lỏng là gì?
Đây là một hợp chất vô cơ có công thức hóa học NH3. Trong điều kiện tiêu chuẩn, đây là chất khí độc, có mùi hôi thối, tan nhiều trong nước, ở dạng dung dịch NH4OH là dung dịch bazơ yếu, phân hủy thành khí NH3 và nước.
Đun sôi ở nhiệt độ -33,34 độ C ở áp suất một atm nên hóa chất được bảo quản dưới áp suất hoặc ở nhiệt độ thấp. Đông lạnh ở -77,7 độ C cho tinh thể màu trắng.
Amoniac lỏng công nghiệp thường chứa 28% NH3 trong nước và được chứa trong các bể đốt vận chuyển bằng ô tô hoặc xe bồn.
II. Tính chất hóa học của Amoniac – NH3
- Khi NH3 hòa tan trong nước, một phần nhỏ phân tử kết hợp với ion H+ của nước tạo thành cation amoni và giải phóng anion. Lúc này nước sẽ đóng vai trò là axit.
- Do tính chất bazơ nên dung dịch amoniac chuyển sang màu xanh tím quỳ và dung dịch phenolphlatein chuyển sang màu hồng. Vì vậy, để phát hiện amoniac người ta dùng quỳ tím ẩm để nhận biết.
- Amoniac dễ bị phân hủy trong dung dịch giải phóng khí amoniac.
- Phản ứng với axit: Amoniac lỏng dễ dàng trung hòa axit tạo thành muối amoni.
- Phản ứng với dung dịch muối: Dung dịch amoniac có khả năng kết tủa nhiều hydroxit kim loại khí phản ứng.
- Amoniac có tính chất khử.
- Không ổn định bởi nhiệt, nó có thể bị phân hủy ở nhiệt độ cao bởi các phản ứng hóa học:
2NH3 → N2 + 3H2 N2 + 3H2 → 2NH3
-
Hiệu quả với các ion kim loại chuyển tiếp và các ion phức: 2NH3 + Ag+ → [Ag(NH3)2]+
-
Nguyên tử hydro trong NH3 có thể được thay thế bằng nguyên tử kim loại kiềm hoặc nhôm:
2NH3 + 2Na → 2NaNH2 + H2 (350 °C)
2NH3 + 2Al → 2AlN + 3H2 (800-900 °C)
-
Tác dụng với dung dịch muối: Dung dịch amoniac có khả năng kết tủa nhiều hydroxit kim loại khí phản ứng.
-
Do tính chất bazơ nên dung dịch amoniac chuyển sang màu xanh tím, còn dung dịch phenolphlatein chuyển sang màu hồng.
-
Amoniac hòa tan trong nước.
-
Amoniac phản ứng với axit tạo thành muối amoni.

Amoniac làm quỳ tím chuyển sang màu tím
III. Amoniac được tìm thấy ở đâu?
- Trong tự nhiên, amoniac được tạo ra từ sự phân hủy các hợp chất hữu cơ từ động vật và thực vật và tồn tại với lượng tương đối nhỏ trong khí quyển.
- Amoniac và một số muối amoni có trong nước biển.
- Amoni clorua và amoni sunfat được hình thành từ các vụ phun trào núi lửa.
- Tinh thể amoni bicarbonate xuất hiện ở một số khu vực khoáng sản có chứa soda.
- Amoniac cũng được tạo ra từ sự bài tiết hàng ngày của động vật và con người qua nước tiểu, vì các cơ quan thận sản xuất một lượng nhỏ khí amoniac.
- Ngoài ra, amoniac còn được tạo ra từ các nhà máy sản xuất phân urê hoặc từ phản ứng hóa lỏng khí Nitơ và Hydro ở nhiệt độ 400 – 450 o C và áp suất 200 – 300 atm để tạo ra amoniac lỏng.
IV. Cách điều chế amoniac – NH3?
1. Điều chế NH3 trong phòng thí nghiệm
2NH4Cl + Ca(OH)2 → NH3 + CaCl2 + H2O
2. Điều chế NH3 trong công nghiệp
NH3 được tạo thành từ azot và hydro liên kết với nhau. Azot thu được từ không khí và hydro được tạo ra từ nước. Sau khi được sấy khô, nung nóng và nén ở nhiệt độ 530 o C, hỗn hợp này (azot, hydro) được đưa qua các liên kết muối khác nhau để tạo thành amoniac.
Để điều chế NH3 trong công nghiệp người ta thường sử dụng các công nghệ sản xuất amoniac phổ biến nhất như sau:
- Công nghệ Haldor Topsoe.
- Công nghệ MW Kellogg.
- Công nghệ Krupp Uhde.
- Công nghệ ICI.
- Công nghệ Brown & Root.
Trong số đó, công nghệ Haldor Topsoe được ứng dụng rộng rãi nhất để sản xuất NH3 trong công nghiệp, chiếm 50% thị trường thế giới. Phải kể đến các nhà máy sản xuất phân đạm ở Việt Nam đều áp dụng công nghệ này để sản xuất NH3.
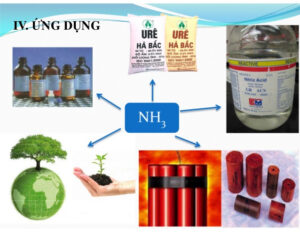
V. Amoniac lỏng dùng để làm gì?
1. Phân bón
Trên thực tế, khoảng 83% amoniac lỏng được sử dụng làm phân bón vì tất cả các hợp chất nitơ đều có nguồn gốc từ NH3, rất cần thiết cho sự phát triển của thực vật.
Năm 2004, amoniac được sử dụng làm phân bón, muối hoặc dung dịch. Khi bón vào đất, giúp tăng năng suất cây trồng như ngô và lúa mì.
Tiêu thụ hơn 1% tổng năng lượng nhân tạo, sản xuất amoniac là thành phần chính trong ngân sách năng lượng của thế giới.
2. Dùng làm thuốc tẩy
Amoniac sử dụng trong gia đình là dung dịch NH3 trong nước dùng làm chất tẩy rửa cho nhiều bề mặt. Amoniac lỏng tạo ra ánh sáng rực rỡ. Đặc biệt, amoniac được dùng để lau kính, sứ, inox, hoặc dùng để lau lò nướng, ngâm các vật dụng để làm sạch bụi…
3. Trong ngành dệt may
Amoniac lỏng được sử dụng để xử lý nguyên liệu bông, tạo ra đặc tính kiềm bóng khi sử dụng chất kiềm. Đặc biệt, nó được dùng để rửa tiền len.
4. Xử lý môi trường khí thải
Amoniac lỏng được sử dụng trong xử lý môi trường để loại bỏ các chất Nox, Sox có trong khí thải từ nhiên liệu hóa thạch như than đá, đá…
5. Là chất kháng khuẩn trong thực phẩm
Amoniac là một chất khử mạnh. Amoniac khan hiện đang được sử dụng thương mại để giảm hoặc loại bỏ ô nhiễm vi khuẩn trong thịt bò.
6. Trong ngành chế biến gỗ
Amoniac lỏng được sử dụng trong chế biến gỗ, làm cho màu sẫm hơn do khí amoniac phản ứng với tannin tự nhiên trong gỗ và làm thay đổi màu đẹp hơn.

Amoniac lỏng được sử dụng rộng rãi trong sản xuất và đời sống
VI. Độc tính và cách điều trị amoniac
1. Độc tính của amoniac
Khí amoniac ở nồng độ đậm đặc cực kỳ nguy hiểm đối với sức khỏe con người. Cụ thể như sau:
- Hít phải: Gây bỏng màng nhầy của mũi, họng và đường hô hấp. Điều này sẽ phá hủy đường hô hấp dẫn đến suy hô hấp vì amoniac có tính ăn mòn cao.
- Tiếp xúc trực tiếp: Gây bỏng nặng ở da, mắt, cổ họng và phổi. Chấn thương do bỏng có thể gây mù vĩnh viễn, bệnh phổi hoặc thậm chí tử vong.
- Nuốt phải: Nếu vô tình nuốt phải amoniac đậm đặc, nó có thể gây bỏng miệng, cổ họng và dạ dày, đau bụng dữ dội và nôn mửa.
2. Xử lý ngộ độc amoniac như thế nào?
Amoniac ở nồng độ cao rất độc hại với con người nhưng không phải ai cũng biết cách xử lý khi tiếp xúc và ngộ độc amoniac. Đây là cách hiệu quả nhất để xử lý nó:
- Khi hít phải khí amoniac, nhanh chóng di chuyển nạn nhân đến nơi thông thoáng và cởi bỏ quần áo dính amoniac.
- Súc miệng bằng nước sạch trường hợp nuốt phải amoniac, uống 1-2 cốc sữa ngay sau đó.
- Nếu tiếp xúc với dung dịch amoniac, hãy rửa sạch amoniac khỏi da và rửa mắt bằng nhiều nước.
- Cuối cùng, đưa nạn nhân đến trạm y tế hoặc bệnh viện để điều trị kịp thời.
VII. Cách bảo quản và vận chuyển NH3 an toàn
1. Những lưu ý khi bảo quản NH3
- Bảo quản NH3 trong thùng hoặc thùng chứa chất lỏng có nhãn rõ ràng.
- Không đổ NH3 lỏng quá 80% thể tích bể.
- NH3 cần được bảo quản trong thùng kín, nơi khô ráo, thoáng mát, riêng biệt và thông gió tốt, tránh xa những nơi có thể gây cháy. Tránh nhiệt độ, độ ẩm và tránh xa các vật thể không tương thích.
2. Những lưu ý để vận chuyển NH3 an toàn
- Với NH3 ở dạng dung dịch amoniac, hoặc amoniac lỏng cần được chứa trong bồn chứa chất lỏng và vận chuyển bằng ô tô, xe bồn.
- Xe phải có mui và thành bên chắc chắn.
- Không trộn lẫn người và vật liệu dễ cháy. Các thùng chứa được xếp ở tư thế đứng từng thùng một, giữa các thùng phải có lớp đệm.
- Bốc dỡ thùng chứa một cách nhẹ nhàng, không để sản phẩm ở những nơi có nhiệt độ cao.
VIII. Triệu chứng ngộ độc amoniac
Nếu bạn hít phải, nuốt hoặc chạm vào các sản phẩm có chứa lượng lớn amoniac sẽ dẫn đến ngộ độc. Sau đây là các triệu chứng ngộ độc NH3:
- Hô hấp: Ho, đau ngực, đau thắt ngực, khó thở, thở nhanh và thở khò khè.
- Mắt, miệng, họng: Có dấu hiệu chảy nước mắt, mù lòa. Đau họng nặng, đau miệng, sứt môi.
- Tim mạch: Tim đập nhanh, mạch yếu, sốc.
- Thần kinh: Lú lẫn, đi lại khó khăn, chóng mặt, thiếu phối hợp, bồn chồn, choáng váng và dễ gây tử vong.
- Da: Bỏng nặng nếu tiếp xúc với NH3 thời gian dài.
- Dạ dày và đường tiêu hóa: Đau dạ dày dữ dội, buồn nôn và khó chịu.
IX. Mua amoniac lỏng ở đâu chất lượng?
Theo đánh giá của nhiều khách hàng, Trường Chu Văn An là địa chỉ tin cậy cung cấp, phân phối hóa chất phòng thí nghiệm, hóa chất công nghiệp được sản xuất tại các nước nổi tiếng trên thế giới với chất lượng tốt nhất, đảm bảo. phục vụ hiệu quả quá trình nghiên cứu, học tập và sản xuất.
Khách hàng mua hóa chất amoniac lỏng tại vietchem sẽ nhận được những ưu đãi như:
- Bạn có thể tham khảo trực tiếp các sản phẩm tại gian hàng vietchem.com.vn với thông tin đầy đủ về các mặt hàng.
- Phương thức thanh toán nhanh chóng, bạn có thể thanh toán trực tiếp hoặc chuyển khoản.
- Có hệ thống vận chuyển linh hoạt, có thể đáp ứng cả số lượng hàng hóa bán buôn hoặc bán lẻ.
- Các sản phẩm hóa chất amoniac lỏng luôn đảm bảo chất lượng tốt nhất, chính hãng với giá cả hợp lý.
- Ngoài ra, còn có hệ thống nhân viên có trình độ chuyên môn cao, thái độ phục vụ chuyên nghiệp, có thể tư vấn 24/7 giải đáp mọi thắc mắc cho khách hàng.
Hãy liên hệ HOTLINE 0826 010 010 để được tư vấn và sở hữu ngay các loại sản phẩm. Amoniac lỏng chất lượng tốt nhất.
X. Những câu hỏi thường gặp về Amoniac
Dung dịch amoniac trong nước chứa những ion nào?
Dung dịch amoniac chứa hai loại ion chính: ion amoni (NH4+) và ion hydroxyl (OH-). Khi amoniac (NH3) hòa tan trong nước (H2O) sẽ xảy ra phản ứng hóa học tạo ra ion amoni và ion hydroxyl theo phương trình hóa học sau:
NH3 + H2O ⇌ NH4+ + OH-
Dung dịch amoniac có làm đổi màu quỳ tím không?
Dung dịch amoniac không làm đổi màu quỳ tím. Dung dịch amoniac là dung dịch kiềm nhưng không làm đổi màu quỳ tím. Trên thực tế, dung dịch amoniac thường được dùng để “phủ” giấy quỳ đỏ, khiến nó trở về màu trung tính (màu tím đỏ ban đầu) sau khi chuyển sang màu đỏ do tiếp xúc với dung dịch axit.
Tính chất của dung dịch amoniac trong nước là gì?
Dung dịch nước có tính kiềm (còn gọi là bazơ). Khi amoniac (NH3) hòa tan trong nước (H2O), phản ứng hóa học xảy ra tạo thành ion amoni (NH4+) và ion hydroxyl (OH-).
Ion hydroxyl (OH-) là một chất kiềm trong dung dịch, khi có nồng độ cao sẽ tạo thành môi trường kiềm mạnh. Do đó, dung dịch NH3 trong nước có tính kiềm và có thể dùng để điều chỉnh độ pH trong một số ứng dụng công nghiệp và thực hành hóa học.
Trong amoniac nitơ có số oxi hóa là bao nhiêu?
Trong amoniac (NH3), nguyên tố nitơ (N) có số oxi hóa là -3.
Mùi amoniac là gì?
Mùi NH3 được mô tả là hăng, đặc trưng và dễ nhận biết. Nếu bạn đã từng sử dụng các sản phẩm có chứa NH3 như dung môi hóa học, sữa rửa mặt hay các sản phẩm tẩy rửa khác thì có thể nhận ra mùi này.
Ngoài ra, NH3 cũng có mùi tương tự khi bay hơi từ dung dịch amoniac (NH3) hoặc các sản phẩm có chứa amoniac như phân bón, chất tẩy rửa hoặc trong môi trường công nghiệp.
XEM THÊM:
>>> Khí hóa lỏng amoniac NH3



Nội dung được phát triển bởi đội ngũ truongchuvananhue.edu.vn với mục đích chia sẻ và tăng trải nghiệm khách hàng. Mọi ý kiến đóng góp xin vui lòng liên hệ tổng đài chăm sóc: 1900 0000 hoặc email: hotro@truongchuvananhue.edu.vn