Nội dung bài viết
Tìm hiểu về H2O2 – HYDROGEN PEROXIDE. H2O2 là gì đang thu hút sự quan tâm của rất nhiều bạn đọc ở thời điểm hiện tại. Trong nội dung dưới đây, Vũ Hoàng sẽ tổng hợp những thông tin cần thiết. Để bạn đọc có thể tham khảo và áp dụng vào các lĩnh vực cần thiết.
 Tìm hiểu về H2O2 – HYDROGEN PEROXIDE
Tìm hiểu về H2O2 – HYDROGEN PEROXIDE
Khái niệm Hydrogen Peroxide là gì? Tìm hiểu về H2O2
Hydrogen peroxide, hoặc hydrogen peroxide (thường được gọi là hydrogen peroxide với công thức hóa học H2O2). Nó là một chất oxy hóa lỏng trong suốt với đặc tính nhớt. Có đặc tính oxy hóa mạnh, nó là chất tẩy trắng mạnh được sử dụng làm chất khử trùng. Cũng như một chất oxy hóa, và (đặc biệt ở nồng độ cao như HTP) như một chất đẩy trong tên lửa.
Tìm hiểu về H2O2 – Tính chất vật lý
Tính chất vật lý của H2O2 là gì?
Hydrogen peroxide có hình dạng “lệch”, do lực đẩy giữa các cặp đơn độc trên các nguyên tử oxy. Mặc dù trên thực tế, liên kết OO là một liên kết đơn. Phân tử này có rào cản cao đáng kể đối với chuyển động quay hoàn hảo là 29,45 kJ/mol. Nó được gây ra bởi lực đẩy của cặp đơn độc.
Góc liên kết bị ảnh hưởng chủ yếu bởi liên kết hydro. Nó giải thích sự khác biệt giữa dạng hơi và dạng tinh thể. Thật vậy, người ta đã quan sát thấy nhiều giá trị khác nhau trong các tinh thể chứa phân tử H2O2.
Tìm hiểu về H2O2 – Tính chất hóa học
Tính chất hóa học của H2O2 là gì?
Hydrogen peroxide có thể phân hủy tự nhiên thành nước và oxy. Thông thường nó phản ứng như một tác nhân oxy hóa. Nhưng có nhiều phản ứng trong đó nó đóng vai trò là chất khử, giải phóng oxy dưới dạng sản phẩm phụ. Nó cũng tạo ra peroxit vô cơ và hữu cơ rất nhanh.
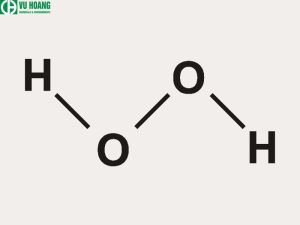 Công thức hóa học H2O2
Công thức hóa học H2O2
Sự phân hủy
Hydro peroxide thông thường tự nhiên phân hủy tỏa nhiệt thành nước và oxy:
2H2O2 → 2H2O + O2 + Nhiệt
Phản ứng này là tích cực; nó có ΔH° -98,2 kJ/mol và ΔG° -119,2 kJ/mol. Tốc độ phân hủy phụ thuộc vào nhiệt độ và nồng độ peroxide. Cũng như độ pH và sự hiện diện của chất ổn định hoặc tạp chất. Hydrogen peroxide không tương thích với nhiều chất xúc tác cho sự phân hủy của nó. Bao gồm phần lớn các kim loại chuyển tiếp và các hợp chất của chúng. Các chất xúc tác phổ biến nhất là mangan dioxide, kali permanganat và bạc.
Phản ứng tương tự cũng được xúc tác bởi enzyme catalase, được tìm thấy trong gan. Chức năng chính của nó trong cơ thể là loại bỏ các sản phẩm phụ độc hại của quá trình trao đổi chất và giảm stress oxy hóa. Sự phân hủy xảy ra nhanh hơn trong các chất kiềm. Vì vậy axit thường được thêm vào làm chất ổn định.
Khi có mặt chất xúc tác nhất định, chẳng hạn như Fe2+ hoặc Ti3+, quá trình phân hủy có thể diễn ra theo một cách khác. Với các gốc tự do như HO· (hydroxyl) và HOO· được tạo ra. Sự kết hợp giữa H2O2 và Fe2+ được gọi là thuốc thử Fenton.
Xem thêm: >>> Những điều cần biết về H2O2 – Hydrogen Peroxide
Phản ứng oxi hóa khử
Trong dung dịch nước, hydro peroxide có thể oxy hóa hoặc khử nhiều loại ion vô cơ. Khi nó hoạt động như một chất khử, khí oxy được tạo ra. Trong dung dịch axit, ion sắt(II) Fe2+ bị oxy hóa thành ion sắt Fe3+,
2Fe2+ (dung dịch) + H2O2 + 2H+ (dung dịch) → 2Fe3+ (dung dịch) + 2H2O (lỏng)
và sunfit (SO32−) bị oxy hóa thành sunfat (SO42−). Tuy nhiên, thuốc tím bị khử thành mangan(II) Mn2+ bởi tính axit của H2O2. Điều thú vị là trong điều kiện kiềm, một số phản ứng này bị đảo ngược. Mn2+ bị oxy hóa thành Mn4+ (ở dạng MnO2), còn Fe3+ bị khử thành Fe2+.
2Fe3+ + H2O2 + 2OH− → 2Fe2+ + 2H2O + O2↑
Hydrogen peroxide thường được sử dụng làm chất khử trong hóa học hữu cơ. Một ứng dụng là oxy hóa thioether thành sulfoxide. Ví dụ, metyl phenyl sulfua bị oxy hóa thành metyl phenyl sulfoxit với hiệu suất 99% trong metanol. Thời gian 18 giờ (hoặc 20 phút với xúc tác TiCl3):
Ph-S-CH3 + H2O2 → Ph-S(O)-CH3 + H2O
Hydro peroxide được kiềm hóa được sử dụng để epoxid hóa các anken thiếu điện tử như axit acrylic. Cũng như quá trình oxy hóa alkylborans thành rượu, bước thứ hai của quá trình hydrobor hóa-oxy hóa.
Tạo thành hợp chất peroxide
Hydrogen peroxide là một axit yếu (pH = 4,5) và nó có thể tạo thành muối hydro peroxide hoặc peroxit hoặc dẫn xuất của nhiều kim loại. Ví dụ, với dung dịch axit cromic (CrO3) nó có thể tạo ra peroxit CrO(O2)2 màu xanh không ổn định. Nó cũng có thể tạo ra peoxoanion khi phản ứng với anion. Ví dụ, phản ứng với borax tạo ra natri perborat, là chất tẩy rửa được sử dụng trong bột giặt:
Na2B4O7 + 4H2O2 + 2NaOH → 2Na2B2O4(OH)4 + H2O
H2O2 chuyển đổi axit cacboxylic (RCOOH) thành axit peroxy (RCOOOH). Bản thân chúng được sử dụng làm tác nhân oxy hóa. Hydrogen peroxide phản ứng với axeton để tạo ra axeton peroxit. Và nó tương tác với ozone để tạo ra dihydrogen trioxide. Phản ứng với urê tạo ra carbamide peroxide, được dùng để làm trắng răng. Cân bằng axit-bazơ với oxit triphenylphosphine là chất mang H2O2 hữu ích trong một số phản ứng.
Tính cơ bản
Hydrogen peroxide là một bazơ yếu hơn nước. Nhưng nó có thể tạo ra một số sản phẩm có axit rất mạnh. Siêu axit HF/SbF5 tạo ra các hợp chất không ổn định chứa ion (H3O2)+.
Tìm hiểu về H2O2 – Ứng dụng
trong gia đình
Khi ở nồng độ thấp (dưới 5%), nó thường được sử dụng để làm sạch tóc hoặc vết thương của con người ở một mức độ nhất định. Ở nồng độ cao hơn nó có thể gây bỏng da khi tiếp xúc. Ở nồng độ rất thấp (3%), nó được sử dụng trong y học để rửa vết thương và loại bỏ mô chết.
Cục Quản lý Thực phẩm và Dược phẩm Hoa Kỳ đã phê duyệt việc sử dụng 3% hydro peroxide (“Cấp thực phẩm” hoặc không bổ sung hóa chất ổn định) làm nước súc miệng. Dung dịch peroxide thương mại (chủ yếu là H2O2 mua ở hiệu thuốc). Nó không thích hợp để dùng qua đường uống do chúng có chứa các hóa chất bổ sung độc hại.
Một số người làm vườn và nuôi cá cảnh đã ca ngợi giá trị của hydrogen peroxide trong dung dịch nước của họ. Họ cho rằng sự phân hủy tự nhiên của nó sẽ giải phóng oxy cho thực vật. Nó có thể làm tăng sự phát triển của rễ cũng như giúp điều trị rễ thối, là những tế bào chết do thiếu oxy.
Peroxide thương mại, chẳng hạn như dung dịch 3% mua ở hiệu thuốc. Có thể được sử dụng để loại bỏ vết máu trên quần áo và thảm.
Kho
Vì hydrogen peroxide phân hủy khi có ánh sáng nên nó cần được bảo quản ở điều kiện mát mẻ và tránh ánh nắng trực tiếp. Nó cũng cần được bảo quản trong chai có nhãn mác rõ ràng, xa tầm tay trẻ em vì nếu uống nhầm với số lượng lớn có thể gây ra các vấn đề về hệ tiêu hóa như bỏng, chấn thương và nôn mửa.
Dung dịch đậm đặc hơn, chẳng hạn như 35%, sẽ gây tử vong khi nuốt phải.
Ứng dụng công nghiệp
Khoảng 50% sản lượng hydrogen peroxide của thế giới năm 1994 được sử dụng để tẩy trắng giấy và bột giấy. Các ứng dụng tẩy trắng khác đang trở nên quan trọng hơn vì hydro peroxide được coi là chất thay thế tốt hơn về mặt môi trường cho các chất tẩy gốc clo.
Các ứng dụng công nghiệp chính khác của nó bao gồm sản xuất natri percarbonate và natri perborat, được sử dụng làm chất tẩy rửa nhẹ trong bột giặt. Nó cũng được sử dụng trong sản xuất một số hợp chất peroxide hữu cơ như dibenzoyl peroxide, được sử dụng làm chất mồi gốc tự do trong phản ứng trùng hợp và các phản ứng hóa học khác. Nó cũng được sử dụng để sản xuất epoxit như propylene oxit. Phản ứng với axit cacboxylic tạo ra “per-axit” tương ứng; Ví dụ, axit peacetic được sử dụng trong công nghiệp được điều chế từ axit axetic theo cách này. Tương tự, axit metachlororopeoxybenzoic (MCPBA), được sử dụng rộng rãi trong phòng thí nghiệm, cũng được điều chế từ axit metachlorobenzoic.
Máy đẩy
Sử dụng H2O2 làm chất đẩy có một số ưu điểm như khả năng phân hủy để tạo ra nước và oxy. Nhiên liệu được phun vào buồng phản ứng. Ở đó, chất xúc tác kim loại (đặc biệt là bạc hoặc bạch kim) thường kích thích quá trình phân hủy. Dòng oxy-hơi được tạo ra được sử dụng trực tiếp hoặc trộn với nhiên liệu để đốt.
Là một chất đẩy đơn lẻ (không trộn với nhiên liệu), nó tạo ra xung lực riêng tối đa (Isp) 161 s (1,6 kN·s/kg) khiến nó trở thành chất đẩy hiệu suất thấp. Tên lửa vành đai nổi tiếng của Bell sử dụng hydrogen peroxide làm chất đẩy đơn. Khi bị phân hủy làm chất oxy hóa để đốt cháy nhiên liệu thì xung riêng của nó cao hơn.
Có thể đạt tới 350 giây (3,5 kN·s/kg), tùy thuộc vào loại nhiên liệu. Peroxide đã được sử dụng rất thành công như một chất oxy hóa cho tên lửa đẩy giá rẻ của Anh. Tên lửa Black Knight dùng để phóng vệ tinh của dự án Mũi tên đen.
Tuy nhiên, hydrazine là chất đẩy đơn phổ biến hơn trong tàu vũ trụ. Bởi vì nó có xung lực riêng cao hơn và tốc độ phân hủy thấp hơn.
Xem thêm bài viết: >>>> H2O2 là gì? Ứng dụng của H2O2
Sử dụng y tế
Hydrogen peroxide đã được sử dụng làm chất khử trùng và khử trùng trong nhiều năm. Trong khi việc sử dụng nó đã giảm trong những năm gần đây. Do sự phổ biến của các sản phẩm OTC có mùi vị ngon hơn và sẵn có hơn nên chúng vẫn được nhiều bệnh viện, bác sĩ và nha sĩ sử dụng để khử trùng. Làm sạch và xử lý mọi thứ từ sàn nhà đến ống tủy.
Hydro peroxide 35% cấp thực phẩm được gọi là “hydro peroxide”. Với giá trị y học hoặc trị liệu, nó được coi là liệu pháp hydro peroxide. Những người ủng hộ việc sử dụng sản phẩm này cho rằng nó có thể bị pha loãng. Và được sử dụng trong “liệu pháp siêu oxy hóa” để điều trị bệnh AIDS, ung thư và nhiều bệnh khác. Một số người cũng phàn nàn rằng thông tin về công dụng có lợi của peroxide bị cộng đồng khoa học cấm.
Họ cũng khuyến nghị rằng các bệnh nhân ung thư “nên được chăm sóc bởi các chuyên gia sử dụng các phương pháp điều trị đã được chứng minh và các thử nghiệm lâm sàng đã được phê duyệt về các phương pháp điều trị mới đầy hứa hẹn”.
 Công dụng của H2O2 trong y học
Công dụng của H2O2 trong y học
Tìm hiểu về H2O2 và mua H2O2 ở đâu uy tín, chất lượng?
Công ty Hóa chất Vũ Hoàng với phương châm “Dùng nền tảng uy tín, chất lượng để: Hợp tác – Chia sẻ – Vươn cao”. Chúng tôi có đội ngũ nhân viên có chuyên môn sâu về ngành hóa chất, dụng cụ, thiết bị và chuyên nghiệp trong vận hành. Luôn mang lại sự hài lòng cho khách hàng và luôn tạo dựng niềm tin cho khách hàng. Với sự chuyên nghiệp, nhiệt tình, uy tín, chất lượng và giá cả phải chăng.
Để đặt hàng, vui lòng truy cập HOTLINE hoặc Website: https://vuhoangco.com.vn để được hỗ trợ và tư vấn nhiệt tình về sản phẩm!


Nội dung được phát triển bởi đội ngũ truongchuvananhue.edu.vn với mục đích chia sẻ và tăng trải nghiệm khách hàng. Mọi ý kiến đóng góp xin vui lòng liên hệ tổng đài chăm sóc: 1900 0000 hoặc email: hotro@truongchuvananhue.edu.vn