Nội dung bài viết
Axit nitric là một trong những hợp chất hóa học có tính axit, oxy hóa mạnh được sử dụng rộng rãi trong đời sống hiện nay, đặc biệt là trong lĩnh vực sản xuất công nghiệp. Vậy đặc tính cụ thể của loại hóa chất này là gì, nó được điều chế như thế nào và được ứng dụng như thế nào trong các lĩnh vực khác nhau? Hãy cùng vietchem tìm hiểu về axit nitric qua bài viết dưới đây
I. Axit Nitric – HNO3 là gì?
Axit nitric có công thức hóa học HNO3, gọi là dung dịch hydro nitrat hay còn gọi là axit nitric khan. Axit này được hình thành trong tự nhiên, được tạo ra từ mưa do sấm sét.
II. Cấu trúc phân tử của Axit Nitric – HNO3
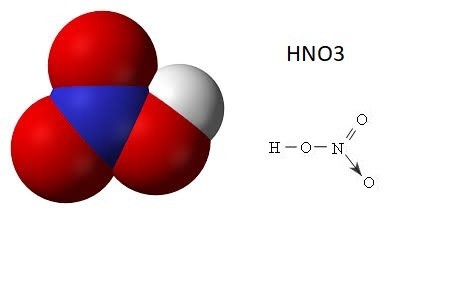
Cấu trúc phân tử – HNO3
III. Tính chất vật lý của axit nitric
- Axit nitric tồn tại ở dạng lỏng hoặc khí, không màu, tan nhanh trong nước (C, 65%). Hợp chất này trong tự nhiên sẽ có màu vàng nhạt do sự tích tụ của các oxit nitơ.
- HNO3 là một axit có tính ăn mòn cao, dễ cháy và cực độc.
- Axit nitric ở nồng độ 86% khi tiếp xúc với không khí sẽ tạo ra khói trắng.
- Mật độ axit nitric tinh khiết: 1511 kg/m3
- Nhiệt độ đông lạnh: -41 độ C
- Nhiệt độ sôi: 83 độ C
- Dưới tác dụng của ánh sáng, axit nitric bị phân hủy tạo thành nitơ dioxide NO2 (ở nhiệt độ thường).
4HNO3 → 4NO2 + 2H2O + O2
-
HNO3 nên bảo quản trong chai tối màu, tránh ánh sáng và bảo quản ở nhiệt độ dưới 0 độ C.
- Axit nitric có thể hòa tan nitơ dioxide thành dung dịch màu vàng hoặc đỏ ở nhiệt độ cao. Điều này ảnh hưởng đáng kể đến tính chất vật lý của chất này, đặc biệt là áp suất hơi đối với chất lỏng, màu sắc dung dịch, nhiệt độ sôi,… tùy thuộc vào nồng độ NO2.
- Khi chưng cất hỗn hợp HNO3 và H2O thu được hỗn hợp đẳng phí có nồng độ 68% HNO3 và sôi ở 120,5 độ C, 1 atm.

Axit nitric tồn tại ở dạng lỏng hoặc khí, không màu, tan nhanh trong nước
IV. Tính chất hóa học của HNO3
Axit nitric là dung dịch hydro nitrat có công thức hóa học HNO3. Đây là một axit khan, một axit đơn mạnh, có tính oxi hóa mạnh, có thể nitrat hóa nhiều hợp chất vô cơ, có hằng số cân bằng axit (pKa) = −2.
Axit nitric là một monoproton chỉ có một độ phân ly nên trong dung dịch nó bị điện phân hoàn toàn thành ion nitrat NO3− và proton hydrat, còn được gọi là ion hydronium.
H3O+ HNO3 + H2O → H3O+ + NO3-
- Axit nitric có tính chất của axit thường nên làm quỳ tím chuyển sang màu đỏ.
- Phản ứng với bazơ, oxit bazơ và muối cacbonat tạo thành muối nitrat
2HNO3 + CuO → Cu(NO3)2 + H2O
2HNO3 + Mg(OH)2 → Mg(NO3)2 + 2H2O
2HNO3 + CaCO3 → Ca(NO3)2 + H2O + CO2
- Axit nitric phản ứng với kim loại: Phản ứng với hầu hết các kim loại trừ Au và Pt tạo thành muối nitrat và nước.
Kim loại + HNO3 đậm đặc → muối nitrat + NO + H2O (lớn)
Kim loại + HNO3 loãng → muối nitrat + NO + H2O
Kim loại + HNO3 loãng lạnh → muối nitrat + H2
Mg(rắn) + 2HNO3 loãng lạnh → Mg(NO3)2 + H2 (khí)
- Nhôm, sắt và crom thụ động với axit nitric đậm đặc lạnh vì lớp oxit kim loại được tạo ra bảo vệ chúng khỏi quá trình oxy hóa thêm.
- Phản ứng với phi kim loại (các nguyên tố kim loại, trừ silicon và halogen) tạo thành nitơ dioxit nếu axit nitric đậm đặc và oxit nitơ với axit loãng và nước, oxit của phi kim loại.
C + 4HNO3 đậm đặc → 4NO2 + 2H2O + CO2
P + 5HNO3 ngưng tụ → 5NO2 + H2O + H3PO4
3C + pha loãng 4HNO3 → 3CO2 + 4NO + 2H2O
- Phản ứng với các oxit, bazơ và muối cơ bản trong đó kim loại trong hợp chất này chưa đạt đến hóa trị cao nhất:
FeO + 4HNO3 → Fe(NO3)3 + NO2 + 2H2O
FeCO3 + 4HNO3 → Fe(NO3)3 + NO2 + 2H2O + CO2
- Tác dụng với các hợp chất:
3H2S + 2HNO3 (>5%) → Kết tủa 3S + 2NO + 4H2O
PbS + 8HNO3 đậm đặc → PbSO4 kết tủa + 8NO2 + 4H2O
Ag3PO4 tan trong HNO3, HgS không phản ứng với HNO3.
- Tác dụng với nhiều hợp chất hữu cơ: Axit nitric có khả năng phân hủy nhiều hợp chất hữu cơ nên sẽ rất nguy hiểm nếu axit này tiếp xúc với cơ thể con người.
V. Điều chế axit nitric – HNO3
Trong tự nhiên, axit nitric được tạo ra từ những trận mưa lớn kèm theo sét, gây ra mưa axit.
1. Điều chế axit nitric – HNO3 trong phòng thí nghiệm
Người ta cho muối natri nitrat kết tinh phản ứng với axit sulfuric đậm đặc và chưng cất hỗn hợp này ở điểm sôi của axit nitric ở 83 °C cho đến khi còn lại chất kết tinh màu trắng. Tuy nhiên, phương pháp này chỉ tạo ra một lượng nhỏ axit.
H2SO4 đậm đặc + NaNO3 (tinh thể) → HNO3 + NaHSO4
Axit nitric bốc khói màu đỏ thu được có thể được chuyển thành axit nitric màu trắng. Khi thực hiện thí nghiệm, dụng cụ phải được làm bằng thủy tinh, đặc biệt là bình cổ cong nguyên khối do axit nitric khan.
2. Điều chế axit nitric – HNO3 trong công nghiệp
Axit nitric loãng có thể được cô đặc thành axit 68% bằng hỗn hợp đẳng phí gồm 32% nước. Để thu được axit có nồng độ cao hơn, tiến hành chưng cất bằng axit sunfuric H2SO4. H2SO4 đóng vai trò là chất khử sẽ hấp thụ lại nước.
4NH3 + 5O2 → 4NO + 6H2O (Pt, 850oC)
2NO + O2 → NO2
4NO2 + O2 + 2H2O → 4HNO3
Dung dịch axit nitric công nghiệp thường có nồng độ 52% và 68%. Việc sản xuất axit nitric được thực hiện bằng công nghệ Ostwald do Wilhelm Ostwald phát minh.
VI. Ứng dụng của axit nitric – HNO3 trong thực tế là gì?

Một số ứng dụng của axit nitric – HNO3
1. Trong phòng thí nghiệm
- Các hợp chất axit nitric chủ yếu được sử dụng làm thuốc thử liên quan đến clorit. Người ta cho HNO3 phản ứng với mẫu thử, sau đó cho dung dịch bạc nitrat vào hỗn hợp thấy có kết tủa màu trắng là bạc clorua.
- Ngoài ra, axit nitric còn được dùng để điều chế muối nitrat.
2. Trong công nghiệp
- Axit nitric 68% được dùng làm thuốc nổ gồm trinitrotoluene (TNT), nitroglycerin, cyclotrimethylenetrinitramine (RDX), các loại phân bón chứa nitơ như phân đạm amoni nitrat NH4NO3, các muối nitrat như Ca(CO3)2, KNO3,…
- Nồng độ HNO3 0,5 – 2% được sử dụng làm hợp chất nền để xác định xem kim loại có tồn tại trong dung dịch hay không. Họ gọi đó là kỹ thuật ICP-AES và ICP-MS. Để có kết quả phân tích chính xác phải sử dụng HNO3 tinh khiết tuyệt đối.
- HNO3 phản ứng với hầu hết các hợp chất hữu cơ nên được sử dụng rộng rãi trong luyện kim, tinh chế và xi mạ. Khi axit nitric phản ứng với axit clorua, chúng ta thu được dung dịch nước cường toan có khả năng hòa tan bạch kim.
- Axit nitric cũng được sử dụng trong sản xuất các chất hữu cơ, sơn, bột màu và thuốc nhuộm vải.
- HNO3 còn được dùng làm chất tẩy trắng để phân biệt morphin và heroin.
- Hợp chất HNO3 được dùng để sản xuất nitrobenzen – tiền chất sản xuất anilin và các dẫn xuất của nó – ứng dụng chủ yếu trong sản xuất sợi aramid, bọt polyurethane và dược phẩm.
- Axit nitric còn là hợp chất trung gian trong sản xuất chất kết dính, chất phủ, chất bịt kín và chất đàn hồi từ toluene diisocyanate.
- Trong các nhà máy sản xuất sữa, người ta sử dụng HNO3 làm chất tẩy rửa đường ống và bề mặt kim loại.
- Axit nitric còn được dùng để loại bỏ tạp chất và cân bằng tiêu chuẩn nước.
- Một trong những ứng dụng khác của IWFNA là làm chất oxy hóa trong nhiên liệu lỏng tên lửa.
VII. Mua axit nitric ở đâu tại Hà Nội, TP.HCM
Trường Chu Văn An là công ty nhập khẩu và phân phối hóa chất công nghiệp, dụng cụ thí nghiệm, thiết bị khoa học kỹ thuật hàng đầu tại Việt Nam, nhận được sự ủng hộ và tin tưởng của khách hàng trên toàn quốc. Với hệ thống hơn 50 xe tải cùng đội ngũ nhân viên giao hàng nhanh nhẹn, nhiệt tình và trách nhiệm, chúng tôi cam kết cung cấp cho khách hàng những sản phẩm chất lượng cao, đúng thời gian. với giá cả cạnh tranh nhất.
Các sản phẩm hóa chất của Trường Chu Văn An được kiểm tra chất lượng nghiêm ngặt từ nguyên liệu đầu vào đến thành phẩm cuối cùng. Mọi quy trình sản xuất từ khâu chuẩn bị đến đóng gói và giao hàng đều được giám sát chặt chẽ bởi các kỹ sư có trình độ chuyên môn cao, theo tiêu chuẩn quản lý chất lượng ISO 9001:2015 và quản lý môi trường theo tiêu chuẩn hệ thống ISO. 14001: 2015.
Hiện nay công ty chúng tôi đang phân phối dung dịch Axit Nitric HNO3 68%, Hàn Quốc. Nếu bạn đang băn khoăn và chưa biết mua axit nitric ở đâu để đảm bảo chất lượng, hãy nhấc máy lên và gọi tới đường dây nóng của vietchem 0826 010 010 để được tư vấn và báo giá tốt nhất.
Xem thêm:
- AXIT SUNFURIC – HÓA CHẤT CÔNG NGHIỆP QUAN TRỌNG NHẤT HIỆN NAY


Nội dung được phát triển bởi đội ngũ truongchuvananhue.edu.vn với mục đích chia sẻ và tăng trải nghiệm khách hàng. Mọi ý kiến đóng góp xin vui lòng liên hệ tổng đài chăm sóc: 1900 0000 hoặc email: hotro@truongchuvananhue.edu.vn